

Kieselalgen (Diatomeen) sind einzellige photoautotrophe Organismen, die sich mit einer zweigeteilten Schale aus Silikat (SiO2) umgeben. Diese stabile Schalenstruktur ist vermutlich für den ausgesprochen großen evolutionären Erfolg der Diatomeen, die nahezu in jedem Wasserhabitat der Erde einen Lebensraum finden, verantwortlich. Die beiden Schalenhälften (Epi- und Hypotheca) bestehen aber nicht nur aus amorph polymerisertem SiO2. Sie enthalten darüber hinaus langkettige Polyamine und Silaffine, die bei der Verknüpfung der Kieselsäure-Monomere [Si(OH)4] zum SiO2 unter physiologischen Bedingungen von entscheidender Bedeutung sind.
Silaffine (silicate affinity) sind kurze Peptide, die in ungewöhnlicher Weise posttranslational modifiziert werden: Neben der Phosphorylierung an einigen Serinresten zeichnen sie sich vor allem durch polykationische Modifikationen an Lysinresten aus, die für die silikatfällenden Eigenschaften der Silaffine verantwortlich gemacht werden. (Kröger et al., Proc. Natl. Acad. Sci. USA 97, 14133-14138, 2000; Kröger et al., J. Biol. Chem. 276, 26066-26070, 2001).
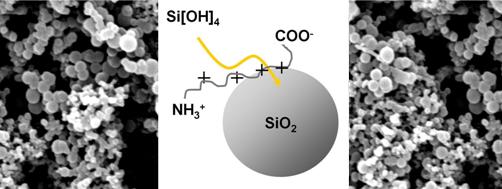
Wir verfolgen den Ansatz, die Kieselsäure-fällenden Eigenschaften der Silaffine zu übernehmen und auf neue Peptide/Proteine zur gerichteten Präzipitation zu übertragen. Peptid-basierte Fällungsagenzien bieten große Variationsmöglichkeiten durch Veränderung der Aminosäure-Sequenz. Das ermöglicht die flexible und zielgerichtete Anpassung sowohl der Fällungsbedingungen als auch der Fällungsprodukte. Zur Produktion der Peptide verwenden wir sowohl Escherichia coli als Expressionssystem als auch festphasengekoppelte Peptid-Synthese, wodurch ein breites Spektrum an Peptiden unterschiedlicher Länge produziert werden kann. Unser Ziel ist es den Fällungsvorgang anwendungsorientiert zu steuern und zu kontrollieren.
Die Möglichkeit, amorphes SiO2 unter physiologischen Bedingungen zu bilden, wird auch dazu verwendet, Proteine und Enzyme unter schonenden Bedingungen in Gegenwart von polykationischen Substanzen in ein Silikatpräzipitat einzuschliessen und so gegenüber störenden Einflüssen wie thermischem Stress zu stabilisieren (siehe z.B. Luckarift et al., Nat Biotech. 22, 211-213, 2004). Neben diesem copräzipitativen Ansatz verfolgen wir die Strategie, Proteine kovalent mit silikatfällungsaktiven Peptiden (siehe oben) auf genetischer oder biochemischer Ebene zu versehen. Davon versprechen wir uns einen engmaschigeren Einschluss in die SiO2-Umgebung mit entsprechend verstärktem Stabilisierungseffekt zum Beispiel gegenüber Temperaturerhöhung. Der majore Hauptlichtsammelkomplex (LHCII) des Photosystems II ist dabei ein besonders geeignetes Untersuchungsobjekt, da sowohl seine trimere Organisation als auch die Bindung seiner 54 Pigmente auf nicht-kovalenten Wechselwirkungen beruhen und damit besonders temperaturempfindlich sind.
