Abb. 1 Vitamin K (Phytonadion)
Phenprocoumon
Von Alfred Goldinger, Mainz
Pharmakologie und Klinik von Phenprocoumon
Erster Teil
In einer kürzlich erschienen Übersichtsarbeit [82] zur Compliance der Patienten bei einer Arzneimitteltherapie wird dargestellt, daß etwa 50% aller Patienten die verschriebenen Arzneimittel überhaupt nicht oder nicht vorschriftsmäßig anwenden. 30% aller verschriebenen Arzneimittel werden derart falsch angewendet, daß ernste Gesundheitsschäden entstehen. Diese Non-Compliance ist unabhängig vom Alter, Geschlecht, Bildungsstand, sozialen Charakter oder von persönlichen charakterlichen Eigenschaften [82]. Die daraus entstehenden volkswirtschaftlichen Kosten sind entsprechend hoch, vom persönlichen Schaden erst gar nicht zu reden.
Es hat sich herausgestellt, daß den Patienten häufig verständliche und korrekte Informationen und Aufklärung über Chancen und Risiken einer Arzneibehandlung fehlen.
Angesichts der zu kurzen, im Durchschnitt weniger als 60 Sekunden dauernden Compliance-bezogenen Information des Arztes über die verordneten Arzneimittel, wird die gesamte vorausgehende Arbeit des Arztes fragwürdig. Zudem vergessen die Patienten fast die Hälfte dessen, was der Arzt ihnen gesagt hat. Der Patient wird nach Verlassen der Arztpraxis häufig alleine gelassen. Fragen zum Zweck der Therapie beantwortet ihm niemand. Durch fehlende sachgerechte Information aufkommende Ängste bezüglich potentieller Nebenwirkungen und anderer Komplikationen provozieren geradezu die Non-Compliance [82].
Genau hier setzt unser Service im Klinikum der Universität Mainz an: Die abschließende Patientenberatung eines in Kürze zu entlassenden Marcumarpatienten.
Die potentiell mangelhafte Compliance bzw. nicht optimale Therapiesituation des Marcumarpatienten ist ein wichtiger Grund gewesen, diesen Service anzubieten und zu versuchen, diese zweifellos unbefriedigende Situation zu verbessern.
Es ist hinreichend bekannt, daß, wenn der Arzt/Apotheker selbst an die Wirksamkeit und Bedeutung der Arzneimitteleinnahme glaubt, sich diese positive Grundhaltung auf den Patienten übertragen läßt. Gerade dieser Aspekt ist natürlich bei der vorliegenden Arzneimittelgruppe der Antikoagulanzien, genauer der Cumarinderivate, überhaupt nicht in Frage gestellt, denn die Notwendigkeit und Wirksamkeit einer solchen Therapie ist unumstritten nachgewiesen.
1994 wurden in der Gesetzlichen Krankenversicherung 827.800 Verordnungen über Marcumar® gezählt mit einem Umsatz von 37.935.100 DM [123].
Bedenkt man, daß in Deutschland z.Z. etwa 300000-500000 Patienten aufgrund verschiedener Erkrankungen (künstlicher Herzklappenersatz, Vorhofflimmern, Beinvenenthrombosen, Lungenembolie etc.) zum Teil lebenslang antikoaguliert werden, so sollte sich der Service alleine schon für diese Patientenclientel hinsichtlich einer Minimierung der Nebenwirkungen lohnen. Aber auch für die Patienten, die nur für einige Monate oder wenige Wochen Cumarinderivate erhalten, kann dieser Service ein Mehr an Qualität im Sinne einer erhöhten Therapiesicherheit bieten.
Diese Patienten bekommen die Cumarinderivate wegen des Auftretens einer Thrombose bzw. zur Verhinderung einer Thrombose verordnet.
Die häufigste Manifestation einer Störung im Hämostasesystem ist die tiefe Beinvenenthrombose [91]. Aber auch in anderen Gefäßen (Herz oder Arterien) kann sie Probleme aufwerfen. Etwa 5% der stationären Patienten weisen eine Thrombose auf, ca. 1-2% bekommen eine Lungenembolie. 90% der Thrombosen entstehen im Venenbereich der unteren Extremitäten und des Beckens, ca. 4% entfallen auf die oberen Gliedmaßen.
Die drei wichtigsten Kausalfaktoren sind (Virchow'sche Trias):
1.Vermehrte Gerinnungstendenz (möglicherweise infolge vermehrter Thromboplastinsubstanzen im Blut, Inhibitorenmangel etc.);
2. Verlangsamte Blutströmung und Randständigwerden der Thrombozyten;
3. Endotheldefekt (evtl. auch funktionelle Insuffizienz der Endothelzellen).
Besprochen werden soll hier die Hyperkoagulabilität des Blutes und deren Behandlung mittels Cumarinderivaten, speziell Phenprocoumon. Außerdem soll unser Marcumar®-Service vorgestellt werden.
2.1.1 Eigenschaften des Phenprocoumon
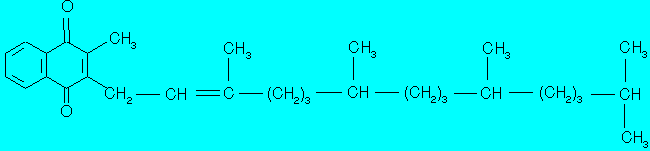
Phenprocoumon ist ein Cumarinderivat, das chemisch mit Vitamin K (WHO) (Phytomenadion [INN], Phytonadione [CFTA, USP21], Phyllochinon) verwandt ist.


Abb. 1 Vitamin K (Phytonadion)
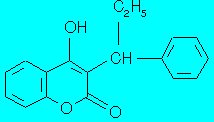
Phenprocoumon
Es ist in der Lage, die Wirkung von Vitamin K zu antagonisieren. Vitamin K wiederum ist
als Kofaktor für die postribosomale Modifikation der Gerinnungsfaktoren
II (Prothrombin), VII (Prokonvertin), IX (Christmas-Faktor), X
(Stuart-Prower-Faktor) und Protein M (Protein M wirkt prokoagulatorisch,
es akzeleriert die Aktivierung von Prokonvertin zu Thrombin) und
der Inhibitoren Protein C und Protein S erforderlich.
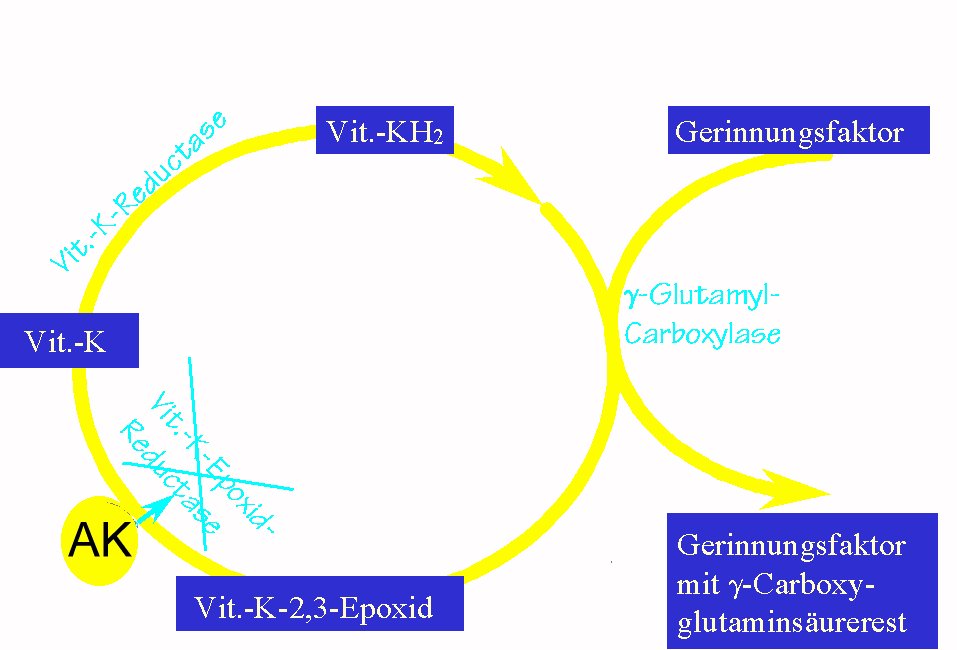
Phenprocoumon hemmt die Epoxidreduktase und dadurch im weiteren die Synthese
der Gerinnungsfaktoren in der Leber um 30-50% [32, 89].
Die Carboxylierung der Glutaminsäurereste der Vitamin
K-abhängigen Gerinnungsfaktoren wird verhindert
 [102].
[102].
Diese Carboxylierung ist kombiniert mit der Oxidation von Vitamin K1 (Phytomenadion) zu der 2,3-epoxid-Form. Phenprocoumon hemmt nun die Zurückführung der Epoxidform in die native Form durch Hemmung der Epoxidreduktase [95]. Die native Form wiederum wird durch eine Vitamin K-Reduktase reduziert zum Vitamin KH2 (Vitamin K-Hydrochinon). Die Vitamin K-abhängige Carboxylaseaktivität (wahrscheinlich identisch mit der Epoxidase [39]) kann in verschiedenen Geweben nachgewiesen werden. Auch andere Proteine haben gamma-Carboxyglutamylreste, woraus sich einige Nebenwirkungen erklären lassen. Osteocalcin beispielsweise, das eine Rolle im Mineralisationsprozeß des Knochens spielt, ist Vitamin K-abhängig [89]. Osteocalcin kann nur dann Hydroxyapatit binden, wenn seine Glutamatreste carboxyliert wurden [69]. Ebenso sind Protein C und Protein S als physiologische antikoagulierende Inhibitoren und Protein Z, dessen Wirkung noch nicht geklärt ist [39], Carboxylase-abhängig. (Seine Funktion liegt wohl in der Wirkung auf die Thrombozytenfunktion.)
Protein C ist ein Vitamin K-abhängiger Inhibitor der Blutgerinnung [50]. Es baut die aktivierten Faktoren V und VIII proteolytisch ab und wirkt durch Verstärkung der fibrinolytischen Aktivität des Gewebe-Plasminogen-Aktivators. Protein C wird durch Thrombin aktiviert. Die Aktivierung wird stark beschleunigt durch den endothelialen Cofaktor Thrombomodulin (Thrombinrezeptor)[14]: Diese Aktivierung ist Calcium-abhängig und benötigt Phospholipide [10]. Die Inhibition der aktivierten Faktoren V und VIII wird beschleunigt durch seinen ebenfalls Vitamin K-abhängigen Kofaktor Protein S. Die Hemmung von aktiviertem Protein C mit Protein C-Inhibitor wird durch Heparin beschleunigt. Ein Mangel an Protein C oder Protein S ist mit einem erhöhten Thromboserisiko verbunden.
Die Antikoagulanzien vom Cumarintyp blockieren also die Regeneration des oxydierten Vitamin K durch Bindung an die Vitamin K-epoxid-reduktase („Warfarin-Rezeptor" [39]) und versursachen somit ein funktionelles Vitamin K-Defizit. Dadurch führen diese Antikoagulanzien zu einer Akkumulation von Vitamin K-epoxid in Leber und Plasma und einer Verarmung von Vitamin KH2 [32]. Es existieren ferner auch Reduktasen (Vitamin K-Reduktase), die weniger empfindlich gegenüber Antikoagulanzien ansprechen[39], aber auf eine relativ hohe Dosis an Vitamin K reagieren. Dies erklärt, daß ausreichend Vitamin K sogar hohe Dosen oraler Antikoagulanzien aufheben kann[39].
Die Antikoagulanzien verursachen aber die Bildung von nur teilweise carboxylierten Proteinen. Diese fehlgebildeten Faktoren werden mit dem Akronym PIVKA -Protein induced by vitamin k absence- bezeichnet. Die Vitamin K-abhängigen Gerinnungsfaktoren enthalten normalerweise 16-13 g-Carboxyglutamat-Reste an ihren Aminoenden. Die g-Carboxyglutaminsäurereste binden Calciumionen und vermitteln die Bindung der Gerinnungsproteine an Phospholipide. Die Calciumbindungsfähigkeit der PIVKAs ist stark (60-90% [89]) vermindert und somit können sie im Ablauf der Gerinnungskaskade nicht aktiv werden. Prothrombinmoleküle beispielsweise mit weniger als 6 g-Carboxyglutamat-Resten haben nur noch ca. 2% ihrer normalen Aktivität, wogegen Moleküle mit 9 g-Carboxyglutamat-Resten 70% ihrer normalen Aktivität aufweisen [32]. Die Gerinnungsfähigkeit des Blutes ist dann stark eingeschränkt. Die geringe Plasmakonzentration der Gerinnungsfaktoren wird auch als Hypoprothrombinämie bezeichnet [41].
Therapeutisch verwendet werden Dicoumarole (Bishydroxycoumarin-Dicumarol® , Ethylbiscoumacetat-Tromexan®) und Monocoumarole (Acenocoumarin-Sintrom®, Warfarin-Coumadin®, Phenprocoumon-Marcumar®)(Tab. 5) . Auf dem deutschen Markt befinden sich zur Zeit folgende Cumarinderivate:
— Warfarin-Natrium: Coumadin®,
— Phenprocoumon: Falithrom® und Marcumar®.
In Deutschland wird vor allem Phenprocoumon (Marcumar®) verwendet.
Alle weiteren Ausführungen gelten also für Phenprocoumon, sofern nichts anderes angegeben ist. Trotzdem sind die meisten Informationen auch für die anderen gebräuchlichen Cumarinderivate gültig.
2.1.2 Kinetik
Phenprocoumon wird nach oraler Gabe nahezu vollständig im oberen Gastrointestinaltrakt resorbiert mit nachweisbaren Plasmaspiegeln nach 1 Stunde und einer Tmax von 2,25 h [63]. Der therapeutische Bereich liegt zwischen 1-5 mg/l Plasma, bei langzeit-antikoagulierten Patienten meist bei 2,5 mg/l [54]. Die Plasmaproteinbindung beträgt > 99% [104]. Gleichzeitige Nahrungsaufnahme kann die Geschwindigkeit, nicht aber das Gesamtausmaß der Resorption vermindern [76].
Phenprocoumon wird in der Leber metabolisiert. Etwa 60% einer oralen Dosis wird zu 4'-, 6- und 7-hydroxy-Analoga umgewandelt, die dann glucuronidiert und im Urin ausgeschieden werden. Ungefähr 40% der oralen Dosis wird konjugiert und ebenfalls renal ausgeschieden [102]. Ein geringer Teil unveränderten Phenprocoumons und seiner Metaboliten wird auch biliär ausgeschieden. Ein Teil der Metaboliten wird glukuronidiert und unterliegt im Darm erneut einem enterohepatischen Kreislauf, um dann renal hauptsächlich als Glukuronid ausgeschieden zu werden [53]. Daher wird bei eingeschränkter Nierenfunktion eine geringere Dosis gegeben, die sich nach dem Quick-Wert bzw. dem INR-Wert (siehe Kapitel 2.1.3) richtet [77]. Nach Normalisierung der Nierenfunktion muß die Dosis entsprechend nach oben angepaßt werden. Ebenso bedarf das nephrotische Syndrom mit einem erhöhten Verteilungsvolumen und einer kürzeren Halbwertszeit aufgrund einer Hypoproteinämie einer entsprechenden Korrektur [89]. Da die Konzentration der Gerinnungsfaktoren und die Albuminkonzentration bei Patienten über 60 Jahren niedriger sind [51], sind geringere Dosen notwendig, um therapeutische Spiegel zu erreichen, als bei jüngeren Patienten [12]. Patienten mit Leberinsuffizienz brauchen keine Dosisanpassung [12], da die Elimination durch Glucoronidierung bei Leberzirrhose nicht vermindert ist[102, 103]. Allerdings gibt es Befunde von Patienten mit Leberzirrhose, die auf eine erhöhte Clearance von Phenprocoumon hinweisen [103]. Außerdem bedeutet eine Leberinsuffizienz auch eine verminderte Syntheseleistung und daher eine niedrigere Konzentration an Gerinnungsfaktoren; von daher ist trotzdem eine vorsichtigere, im allgemeinen niedrigere Dosierung notwendig. Phenprocoumon ist plazentagängig und geht in die Muttermilch über (im Gegensatz zu Warfarin [49, 89]. Die amerikanische pädiatrische Akademie betrachtet Warfarin als mit dem Stillen vereinbar. Trotzdem plädieren manche Autoren dafür, die Gerinnung des Kindes zu überwachen bzw. dem Kind Vitamin K zu geben).
Die Plasmahalbwertszeit beträgt 150-160 Stunden [103], mit einer großen interindividuellen Streuung (76-273 Stunden gleich 3,2-11,4 Tagen)[77]. (Siehe Tab. 5).
Da einerseits die Vitamin K-abhängigen Gerinnungsfaktoren erst erschöpft sein müssen, erfolgt der Wirkungseintritt erst nach 48-72 Stunden. Andererseits dauert die Wirkung 4-7 (< 14) Tage an, bis die beeinflußten Gerinnungsfaktoren ihren physiologischen Level wieder erreicht haben. (Tab. 2) Die Hämostase ist jedoch schon früher, bei Quick-Werten um 50% der Norm kompensiert [53], so daß dann keine erhöhte Blutungsneigung mehr besteht.
Für Warfarinprodukte sind Bioäquivalenzprobleme berichtet worden. Daher empfiehlt es sich nicht, einen Präparatewechsel vorzunehmen.[105].
Mögliche Ursachen für die hohe Variabilität bei manchen Patienten und auch einen veränderten Cumarinbedarf während einer Therapie können durch folgende Einflußgrößen erklärt werden [32, 53, 54]:
1) Arzneimittelinteraktionen
2) Einschränkung der Synthese des Prothrombinkomplexes
a) infolge Lebererkrankung
b) infolge kardialer Dekompensation.
3) Zusätzlicher Vitamin K-Mangel bzw. veränderte Verfügbarkeit von Vitamin K (Änderung in der Ernährung)
4) Interkurrente Krankheiten
5) Alter (in höherem Alter geringerer Bedarf)
6) Individuelle Erbanlage (veränderte Rezeptoraffinität)
7) Änderung in der Patientencompliance
8) Inkonsistente Testungen und Mitteilungen des Labors
9) Wechsel des Fertigarzneimittels
10) Veränderte Pharmakokinetik
11) Mangelhafte Kommunikation zwischen Arzt und Patient
12) Hereditäre Ursache für Antikoagulanzien-Resistenz
2.1.3 Überwachung des Antikoagulanzienspiegels
2.1.3.1 Bestimmung des Quick-Wertes
Grundsätzlich gilt für die Therapie mit Cumarinderivaten, daß eine Dosis gewählt werden muß, die einerseits antithrombotisch ist und andererseits nicht zu Blutungskomplikationen führen sollte. Phenprocoumon (und auch jedes andere Cumarinderivat) muß individuell dosiert werden, da das interindividuelle Ansprechen sehr stark schwanken kann [40]. Patienten, die die Antikoagulanzien langsam metabolisieren, brauchen kleinere Dosen und zeigen stabilere Prothombinzeiten [41].
Die Gerinnungsfähigkeit des Blutes läßt sich am besten mit der Bestimmung der Thromboplastinzeit (auch Prothrombinzeit genannt, abgekürzt PT oder auch TPZ [Quick-Wert]) messen.
Thromboplastinzeit=Prothrombinzeit=Quick-Wert=TPZ
Zu Beginn der Therapie muß der Quick-Wert häufiger bestimmt werden, um herauszufinden, welche Art von Responder der Patient darstellt. Hereditäre Resistenz auf Antikoagulanzien ist mehrfach beschrieben worden [89].
Labor
Citratplasma oder auch Kapillarblut wird mit Gewebs(FIII)thromboplastin versetzt. Unter Thromboplastin versteht man ein Phospholipid-Protein Gewebeextrakt, der sowohl den Gewebefaktor als auch das Phospholipid enthält, das notwendig ist, die Aktivierung von Faktor X durch Faktor VII zu fördern. Nach Zugabe von Calciumchlorid wird die Umwandlung von Prothrombin in Thrombin gestartet und durch das gebildete Thrombin Fibrinogen zu Fibrin umgewandelt. Die Umrechnung der gemessenen Sekundenwerte bis zur Ausbildung eines Fibringerinnsels wird bestimmt, und anhand einer Eichkurve, die mittels der Verdünnungsreihe eines Normalplasmapools erstellt wurde, wird die Gerinnungszeit in Prozent der Norm angegeben. Die Aktivität der Patientenproben wird entweder in Prozent, bezogen auf den Plasmapool (=Quick-Wert) oder als Prothrombinratio (PR) angegeben:
PR = Gerinnungszeit Patientenplasma : Gerinnungszeit Referenz-Normalplasma
Die Thromboplastinzeit erfaßt die Faktoren des exogenen Gerinngunssystems. Die Prothrombin Time Ratio (PR) ist der Quotient aus dem bei dem Patienten gemessenen Zeitwert der Gerinnung geteilt durch den z.Z. der Messung gültigen Normalwert.
- International Normalized Ratio (INR-Wert) Zur Überwachung der Antikoagulanzientherapie werden in Deutschland die Einstufenthromboplastinzeit nach Quick unter Benutzung verschiedener Thromboplastine eingesetzt. Bedingt durch unterschiedliche Empfindlichkeit der Thromboplastin-Reagenzien gegenüber Cumarineffekten können erhebliche, unbeabsichtigte Abweichungen in der Intensität der Antikoagulation auftreten, obwohl der gleiche therapeutische Quick-Wertbereich zugrundegelegt wird. Da in Nordamerika ein Kaninchenhirn-Thromboplastin und in Europa ein Humanhirn-Thromboplastin verwendet wird, differieren die Testergebnisse erheblich und sind nicht vergleichbar. Ein Patient mit einem Verhältnis Prothrombinzeit zur Kontrollzeit gleich 2,5 kann nur etwa halb so stark antikoaguliert sein wie ein amerikanischer Patient mit derselben Reaktion [70].
- International Sensitivity Index (ISI-Wert)
Die wichtigsten Faktoren, die die Thromboplastin-Empfindlichkeit beeinflussen, sind die Herkunft (Human, Kaninchen, Rind), die Quelle (Lunge, Hirn, Plazenta) und die Methode der Aufarbeitung. Dadurch wird ein und dieselbe Probe in verschiedenen Labors oder durch Verwendung verschiedener Chargen eines Tests unterschiedliche Ergebnisse bringen [17, 18] .
Die Hersteller ermitteln für ihre jeweilige Thromboplastincharge einen Empfindlichkeitsfaktor, als International Sensitivity Index (ISI) bezeichnet. Er drückt die Abweichung vom WHO-Standard aus. Je höher der Wert bei 1,0 liegt, desto mehr gleicht das Thromboplastin dem WHO-Standard [5]. Die Verwendung empfindlicher Thromboplastine (geringe ISI-Werte) kann zu einer Subantikoagulation führen, mit dem Risiko thromboembolischer Komplikationen. Umgekehrt führt der Einsatz von weniger empfindlichem Thromboplastin (höhere ISI-Werte) zu einer Hyperantikoagulation mit entsprechendem Blutungsrisiko.
In der Phase der stabilen Antikoagulation sollte daher die Therapiekontrolle und -Steuerung standardisiert, d.h. anhand von INR-Werten erfolgen.
Durch Berechnung der INR-Werte ist es möglich,
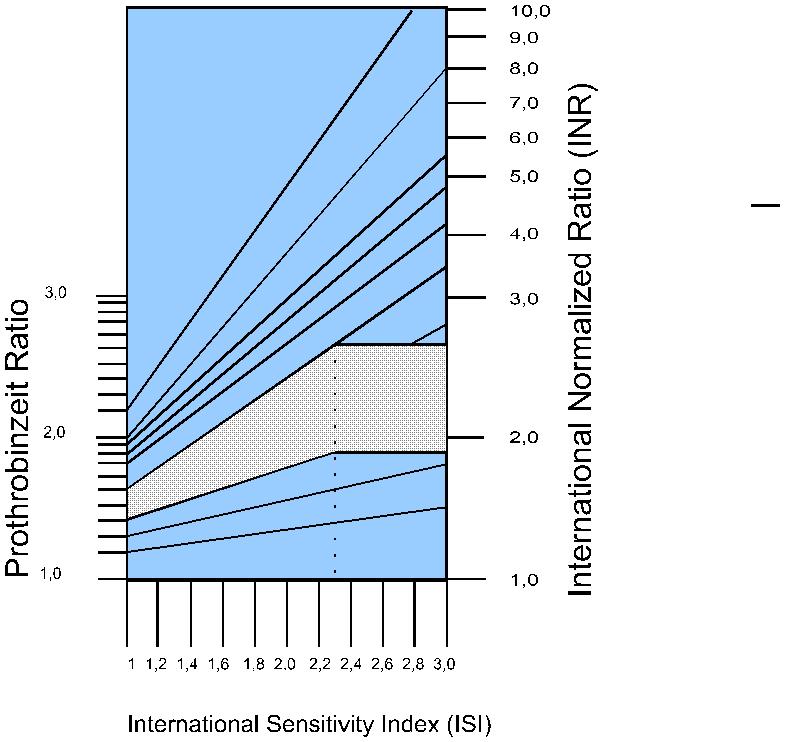
Abb. 4 Relation zwischen der Prothrombinzeit-Ratio (PTR) und der
International Normalized Ratio (INR) für Thromboplastin-Reagenzien
über einen Bereich
von ISI-Werten (International Sensitivity Index)[nach 32].
Das Beispiel zeigt eine Thromboplastin-Präparation mit einer ISI von 2,3
und einer Prothrombinzeit-Ratio von 1,3 bis 1,5; nach der Formel
INR=PTRISI erhält man eine INR von 1,83 bis 2,54.
zuverlässig vergleichbare therapeutische Bereiche der Antikoagulanzien festzulegen, die der jeweiligen Thrombosegefährdung optimal angepaßt sind (Tab. 1[51] ).
Berechnung der „International Normalized Ratio" zur Therapiesteuerung unter stabiler Antikoagulation mit Cumarinen:
1. Zuerst Ermittlung der PR
2. Umrechnung der PR in INR gemäß der Formel:
INR = PRISI
PR: Quotient aus Thromboplastinzeit (Prothrombinzeit) des Patientenplasmas dividiert durch Thromboplastinzeit eines Normalplasmapools (Meist kommerzielles Kalibrations- oder Standardhumanplasma)
ISI: Internationaler Sensitivitätsindex: dieser Index wird vom Hersteller für das jeweilige Thromboplastin chargenspezifisch durch Kalibrierung an einem internationalen Referenzthromboplastin (wird gleich 1,0 gesetzt [96]) ermittelt [17]. Die Steigung der Kalibierungsgeraden im doppelt logarithmischen Koordinatensystem ist der ISI.
Normalbereich 70-120% Quick-Wert ~ INR 1,25-0,9
Therapeutischer Bereich (Beispiel):20-30% bzw. INR 2-4.
Erstes Beispiel: Wird ein Thromboplastin mit einem Sensitivitätsindex von 1,1 verwendet, so entspricht der INR-Bereich von 2,0-3,0 einem Quickwert-Bereich von 24-38%.
Zweites Beispiel:
PR=3,54
ISI=1,08
INR=3,541,08=3,92
Therapiebereich: %Angabe 15-25, PR 2,0-3,0, INR 2,0-4,5
Mit abnehmendem Quick-Wert wird der INR-Wert größer. Die Höhe des angestrebten INR-Wertes ist abhängig von der Grunderkrankung des Patienten bzw. der Stärke der gewünschten Antikoagulation. Mit dem Ziel einer wirksamen Rezidivprophylaxe venöser Thromboembolien bei möglichst geringem Blutungsrisiko wird ein therapeutischer Bereich der INR von 2,0-3,0 angestrebt. Dies entspricht z.B. bei Verwendung eines Thromboplastins mit einem Empfindlichkeitsfaktor von 1,1 einem Quickwertbereich von 24-38%. Bei einem Thromboserezidiv und bei Herzklappenersatz legt man den Bereich mit 3-4,5 INR fest. Selbst ein Nomogramm für diese Berechnungen steht inzwischen zur Verfügung [19]. Wenn im folgenden trotzdem vom „Quick-Wert" die Rede ist, geschieht dies aufgrund der immer noch in der Praxis meist üblichen Nomenklatur, obwohl eindeutig die Bestimmung und Angabe des „INR-Wertes" vorzuziehen ist.
- Prothrombinfragment 1+2 (F1+2)-Bestimmung
Durch Einführung der INR wurde zwar eine Vergleichbarkeit von Thromboplastinpräparationen unterschiedlicher Herkunft ermöglicht und der therapeutische Bereich charakterisiert. Dabei läßt allerdings die Thromboplastinzeit jeweils offen, ob der beim individuellen Patienten induzierte antikoagulatorische Effekt nur zu einer Hypokoagulabilität oder evtl. auch zu einer Hyperkoagulabilität geführt hatte. Bekanntlich kann ein Quick-Wert von z.B. 25% bei einem Patienten schon mit einer Blutungsneigung einhergehen, beim anderen dagegen weitere thromboembolische Komplikationen nicht verhindern. Durch Messung des Prothrombinfragmentes 1+2 läßt sich der erreichte antikoagulatorische Effekt durch orale Cumarinderivate belegen. Bei der Umwandlung von Prothrombin in Thrombin spaltet Faktor Xa 2 Peptidbindungen. Der dabei freiwerdende N-terminale Anteil des Prothrombins wird als Prothrombinfragment 1+2 (F1+2) bezeichnet, das mit spezifischen Antikörpern nachgewiesen werden kann. Je mehr Thrombin gebildet wird, desto höher ist die F1+2-Konzentration. Eine erhöhte Konzentration findet sich bei Patienten mit tiefen Venenthrombosen, Lungenembolien, Myokardinfarkt, Präeklampsie und Eklampsie. Auch Patienten mit kongenitalem AT III- oder Protein C-Mangel können erhöhte Konzentrationen des F1+2-Fragmentes zeigen. Der Abfall des Prothrombinaktivierungpeptides F1+2 unter Cumaringabe bedeutet eine tatsächliche Verminderung der Prothrombinaktivierung. Dadurch ist eine Überprüfung der individuellen Therapieeinstellung möglich. Gerade bei Patienten mit weniger intensiver Antikoagulation (INR <2,0) konnte gezeigt werden, daß die alleinige Analyse der Thromboplastinzeit hinsichtlich ihrer Effizienz in der Unterdrückung der Thrombinbildung und damit der Thrombosegefahr nicht präzise erfaßt wurden. Umgekehrt liegen bei höherer Cumarindosierung die F1+2-Plasmaspiegel überwiegend sogar unterhalb des Normbereichs [52]. Es besteht eine strenge Korrelation zwischen der Höhe des F1+2-Spiegels und dem INR-Wert [55]. Es konnte gezeigt werden, daß gerade die Prothrombinverminderung unter oralen Antikoagulanzien wichtig für die antithrombotische Wirkung oraler Antikoagulanzien ist. Die Konzentration des F1+2 ist innerhalb des Normbereichs um so niedriger, je ausgeprägter die Antikoagulation ist. Für einzelne Patienten scheint daher die Bestimmung des F1+2-Spiegels zur Überprüfung der Effektivität der Antikoagulanzientherapie ein hilfreicher Parameter zu sein.
Die übliche Betreuung der Antikoagulanzien-Patienten mit Quick-Wert-Bestimmungen alle 3-4 Wochen führt dazu, daß nur etwa 50-60% [59] der Patienten im angestrebten Quick-Wertbereich liegen. Neuerdings sind zur Bestimmung der Thromboplastinzeit tragbare Koagulometer im Handel, die Kapillarblut aus der Fingerbeere als Probe verwenden. Damit kann der geübte Patient seinen Quick-Wert schnell und sicher selbst bestimmen. Nach wenigen Minuten zeigt das Gerät die Prozentaktivität der Thromboplastinzeit und auch den INR-Wert auf dem Display an. Dadurch ist es möglich, langzeit-antikoagulierten Patienten neben Eigenverantwortlichkeit auch ein Stück Unabhängigkeit, besonders auf Reisen, zu übertragen. Aber auch die engmaschige Überprüfung des Quick-Wertes bei Dosierungsproblemen ist hier bequem und sicher möglich [51]. Die Bestimmung der Dosierung bleibt beim Arzt, es sei denn, der Patient hat sich als vollkommen sicher in der Beurteilung der selbstbestimmten Werte erwiesen. Solche Geräte zur Selbstbestimmung des Quick-Wertes setzen natürlich eine patientengerechte Schulung über die Blutgerinnung und die orale Antikoagulation sowie eine gründliche Einweisung in die Bedienung des Gerätes voraus [59]. Die Quick-Wert-Selbstkontrolle durch den Patienten verbessert die Behandlungsqualität: Selbstkontroll-Patienten weisen weniger thromboembolische Zwischenfälle und Blutungen auf (bis 90% der selbstbestimmten Werte liegen im therapeutischen Bereich). Die Kapillarblutentnahme schont die Venen. Die Selbstkontrolle gibt mehr Sicherheit auf Reisen und zwischen den Arztbesuchen [59]. Horstkotte und Schultheiss [58] fordern bei chronischen Herzklappenfehlern eine geringe Schwankung der INR-Werte, um eine hinsichtlich thromboembolischen und Blutungskomplikationen optimale Antikoagulanzientherapie zu bekommen. Dies setzt aber häufige Kontrollen der Effektivität der Antikoagulanzien voraus. Da aber durch die heute gängige Praxis der ambulanten Therapieüberwachung in 20-30 tägigen Intervallen die gewünschten engen Therapiekorridore nicht einzuhalten sind, wäre eine Selbstbestimmung der Antikoagulanzienintensität durch den Patienten wünschenswert (CoaguCheck® oder CoaguCheck plus® Boehringer Mannheim) [58].
2.1.4 Dosierung
Cumarinderivate haben bis zum Wirkungseintritt eine Latenzzeit von 36-48 Stunden. Sie sollten deshalb zu Beginn der Therapie möglichst hoch dosiert werden, um einen raschen Abfall der Faktoren des Prothrombinkomplexes zu erreichen [48]. Zur schnellen Aufsättigung geht man am besten vom zunächst zu bestimmenden Quick-Wert aus und dividiert diesen durch zehn. Als Ergebnis erhält man die Anzahl der in den ersten beiden Tagen zu verabreichenden Tabletten. Von dieser Anzahl bekommt der Patient am ersten Tag 2/3 und am zweiten Tag 1/3 der Tabletten [55]. Ergibt die Messung des Quick-Wertes beispielsweise 90% der normalen Gerinnung, so erhält man nach Division mit 10 eine Gesamtanzahl von 9 Tabletten; davon erhält der Patient am ersten Tag 6 Tabletten (gleich 18 mg) und am zweiten Tag 3 Tabletten (gleich 9 mg Phenprocoumon). Diese Vorgehensweise ist nicht unumstritten und viele Autoren halten die Gabe von mehr als 5 Tabletten pro Tag als zu gefährlich hinsichtlich der potentiellen Gefahr einer Cumarinnekrose.Um die Komplikationsgefahr (Cumarinnekrose) möglichst gering zu halten wird neuerdings auch empfohlen, die aus dem Ausgangsquickwert errechnete Menge auf 3-4 Tage zu verteilen und eine Tageshöchstdosis von 3 Tabletten nicht zu überschreiten [55]. Von den Bestimmungen am 3. und 5. Tag (oft auch täglich) hängt die weitere Dosierung ab. Liegt der Quick-Wert oberhalb des therapeutischen Bereichs, werden täglich 1,5, im therapeutischen Bereich 1, unterhalb 1/2 Tablette Phenprocoumon pro die gegeben [48]. Die weiteren langfristigen Erhaltungsdosen belaufen sich im Bereich von 0,75 bis 6 mg Phenprocoumon, entsprechend ¼ bis 2 Tabletten. Spätestens nach einer 14tägigen Behandlung kann man das Kontrollintervall auf wöchentliche Abstände ausdehnen. Bei stabil eingestellten Patienten mit einer Langzeitbehandlung können die Kontrollen auf 4wöchige Abstände festgelegt werden. Von der 3. Woche an sollte als Behandlungseinheit nicht die Tagesdosis, sondern immer die Wochendosis betrachtet werden. Bei nur geringfügigen Abweichungen vom angestrebten Bereich ist bei einem Langzeit-Antikoagulans wie Phenprocoumon eine Korrektur der Wochendosis jeweils nur um 1/2 bis 1 Tablette notwendig [2, 9]. Bei einem zu niedrigen Quick-Wert kann entweder die Dosis reduziert oder aber durch Einschaltung eines Leertages eine Korrektur erfolgen [2].
Eine andere Möglichkeit ist die, daß man unter Beibehaltung der Medikation an einem Tag 1-2 mg Konakion® oral zur Antikoagulanzienmedikation hinzugibt, womit meistens schon der Quick-Wert in den therapeutischen Bereich angehoben wird [2]. Der zu erzielende Quick-Wert beträgt 20-25% (vom Bundesinstitut für Arzneimittel und Medizinprodukte für die Gebrauchsinformation zugelassen) der normalen Gerinnungsfähigkeit (ca. 70-120% )[8]; andere Autoren empfehlen auch 18-27% und höher; dies hängt immer von der jeweiligen Indikation ab.
Falls die Antikoagulation nicht eilt (z.B. beim chronischen stabilen Vorhofflimmern) kann mit einer durchschnittlichen Dosis (z.B. 3 mg Phenprocoumon) begonnen werden, um nach 5-6 Tagen ein Steady-state zu erhalten. Muß eine raschere Antikoagulation angestrebt werden, kann zunächst Heparin gegeben werden und die Phenprocoumon-Dosis mit 2 Tabletten (6 mg) begonnen werden. Nach 4-5 Tagen kann dann Heparin abgesetzt werden, wenn der Quick-Wert im therapeutischen Bereich liegt.
- EDV-gestützte Dosisvorhersage
Zahlreiche Versuche, die Erhaltungsdosis eines Antikoagulans vorherzusagen (incl. Computerprogrammen [101]) sind bislang gescheitert. Die meisten gingen von einer fixen Dosis des Antikoagulans aus und gaben dann ihre Empfehlung aufgrund der Reaktion auf diese fixe Dosis. Dies ist aber sehr problematisch. Viele Patienten reagieren ganz untypisch; außerdem sind die pharmakokinetischen Daten von einer großen Population gewonnen und berücksichtigen dann eben nicht den individuellen Patienten. So sind diese Techniken immer noch nicht zufriedenstellend [113].
Angesichts gehäufter Blutungskomplikationen bei eingestellten Patienten sind einige Zentren insbesondere in den USA dazu übergegangen, eine „Low-dose-Therapie", auch „Mini-Warfarin-Therapie" genannt, durchzuführen mit dem Ziel von INR-Werten um 2,0 [55]. Dies könnte z.B. für Patienten mit Koronarer Herzkrankheit (KHK) sinnvoll sein: Der aktivierte Faktor VII gilt als Risikofaktor für das Auftreten einer KHK [49]. Es könnte daher von Nutzen sein, eine niedrig dosierte Antikoagulanzientherapie mit einem Thrombozytenaggegrationshemmer zu kombinieren. Dies muß allerdings erst noch klinisch untersucht werden. Nach wie vor gilt die niedrig dosierte Acetylsalicylsäure als Mittel der Wahl.
Auch Bruhn und Zurborn [52] stellen fest, daß bei Vorhofflimmern ohne rheumatische Klappenvitien orale Antikoagulanzien in niedriger Intensität empfohlen werden können. Eine weitere Zielgruppe für eine niedrig dosierte Antikoagulanzientherapie sind möglicherweise Patienten mit Inhibitordefekten (Protein C und S, ATIII). Die weniger intensive Antikoagulation (im Vergleich zum früher üblichen Vorgehen mit therapeutischem Quickwertbereich von 15-25% = INR 2,3-4,5;[INR 1,5-2,5=30-50% Quick-Wert; INR 2-3=25-30%) hat sich in kontrollierten Therapiestudien als effektiv und hinsichtlich Blutungskomplikationen sicherer erwiesen [32]. Weniger hohe Initialdosen scheinen offenbar auch geringer toxisch zu sein als hohe Loading-Dosen [68]. Bei letzteren kann das Blutungsrisiko und das Cumarinnekroserisiko erhöht sein[53]. Hull et al. [97] konnten zeigen, daß die low-dose-Warfarin-Therapie (PR=2,2-3,6)genauso effektiv wie die konventionelle Warfarintherapie ist. Das Blutungsrisiko ist bei letzterer signifikant größer. Auch wenn man eine Loading-Dose verabreicht, bleibt die Halbwertszeit der Gerinnungsfaktoren der limitierende Schritt [41]. Studien mit einer Loading-Dose haben gezeigt, daß in den ersten 48 h Prokonvertin (Faktor VII) vermindert und eine Verlängerung der PT gemessen werden kann. Dies erklärt sich durch die kurze Halbwertszeit des Faktors VII (siehe Tab. 1 ). Die Verlängerung der PT reflektiert also nur die rasche Erschöpfung an Faktor VII und bedeutet nicht, daß ein ausreichender Thromboembolie-Schutz gegeben ist. Im Gegenteil: Gerade die Faktoren IX und X sind bedeutend wichtiger in der Pathogenese der Thromboembolie als Faktor VII.
- Übergang Heparin/Phenprocoumon
Da die meisten Patienten wohl zunächst mit Heparin antikoaguliert werden (sofortiger Wirkungseintritt möglich bzw. sofort wirkendes Antidot mit Protamin vorhanden), muß der Arzt den Patienten auf ein Cumarinderivat umstellen, falls eine längerdauernde Antikoagulation erwünscht ist. Diese Umstellung geschieht gewöhnlich so, daß der Patient sowohl Heparin und Phenprocoumon für einige Tage überlappend erhält, so daß jederzeit der Schutz vor einer Thrombose gewährleistet ist. Die Heparin- und Phenprocoumontherapie sollten sich für 4-6 Tage überlappen [98] .Folgende Gründe sind dazu anzuführen:
— Heparin reduziert den ATIII -Level.
— Phenprocoumon reduziert den Protein C- und Protein S-Level [49].
— Der antithrombotische Effekt von Phenprocoumon tritt erst nach etwa 4 Tagen ein (wenn Faktoren II,IX und X reduziert sind).
— Ein früher "therapeutischer" Quick-Wert kann auf das rasche Fallen von Faktor VII zurückzuführen sein, was allerdings keine ausreichende Antikoagulation darstellt.
Nach Absetzen des Heparins ist der ATIII-Level nach ca. 3 Tagen wieder erreicht. Der Erfolg durch Phenprocoumon wird zunächst in einer Senkung von Protein C, S und Faktor VII gesehen. Die Faktoren IX ,X und II sind dagegen erst nach 4-6 Tagen reduziert. Da die PR durch den Faktor VII wesentlich beeinflußt wird, täuscht ein "therapeutischer" PR-Wert nach 2-3 Tagen eine falsche Sicherheit vor. Aus diesen Gründen sollte die Überlappungszeit mindestens 4 Tage betragen. Falls am 4. Tage die PR noch nicht im gewünschten Bereich liegt, müssen noch ein bis 2 Tage weiter überlappend therapiert werden. Da Heparin in hohen Dosen den Quick-Wert beeinflussen kann [40, 99, 100] sollte die TPZ erst 6-8 Stunden [40] (4-5 h nach der letzten i.v.-Gabe oder 12-24 h nach der letzten s.c.-Gabe) nach Absetzen des Heparins gemessen werden und dann täglich bis zur Entlassung. Sollte die Antikoagulanzien-Therapie bei der Entlassung noch nicht stabilisiert sein, sollte je nach Situation, die TPZ noch 2-5 Tage nach Entlassung bestimmt werden. (Siehe Abb. 5)
Vier Wochen lang nach der Entlassung des Patienten aus dem Krankenhaus sollte der Quick-Wert wöchentlich bestimmt werden (siehe Abb. 5). Danach sollte der Patient stabil eingestellt sein. Das Kontrollintervall kann dann auf 4 Wochen erhöht werden [90]. Sollte der TPZ-Wert außerhalb des gewünschten Bereichs liegen, muß die Antikoagulanzien-Dosierung neu bewertet werden und es müssen zunächst engmaschigere TPZ-Bestimmungen durchgeführt werden.
Bei der Lungenembolie hat sich für die Umstellung von Heparin auf orale Antikoagulanzien bewährt, Heparin über 7-10 Tage fortzuführen. 4-5 Tage vor dem geplanten Ende wird mit der oralen Antikoagulanzientherapie begonnen [94].
Mittlerweile stehen auch rekombinierte Thromboplastine, deren gentechnisch hergestellte humane Gewebefaktoren an verschiedene Phospholipide gebunden sind, zur Verfügung [51]. Diese haben gegenüber herkömmlichen Thromboplastinen unter anderem auch den Vorteil, daß sie weitgehend Heparin-unempfindlich sind.
- Dauer der Antikoagulanzientherapie
Bei den meisten thrombosegefährdeten Patienten ist eine 3-4-wöchige Prophylaxe mit Phenprocoumon angezeigt, zumindest solange, bis der Patient ausreichend mobil ist. (Natürlich ist hier auch die Gabe von Heparin oder Low-molecular-weight-Heparin (LMWH) subcutan möglich). Das Ziel bei Langzeitpatienten sollte sein, möglichst kontinuierliche Gerinnungswerte einzustellen, was sich mit den langwirkenden Cumarinen (z.B. Phenprocoumon) am besten erreichen läßt. Eine jüngere Studie hat gezeigt, daß Patienten mit Acenocoumarin häufiger aus dem gewünschten therapeutischen Bereich fielen und schwerer einzustellen waren als Patienten mit dem länger wirksamen Phenprocoumon [85]. Das Risiko venöser thromboembolischer Rezidive ist in den ersten beiden Wochen nach einem Ereignis am größten und nimmt mit der Zeit exponentiell ab. Es läßt sich darstellen, daß Patienten nach erstmaliger venöser Thromboembolie nur während der ersten 3-4 (-6) Monate von einer Antikoagulation profitieren. Bei Patienten mit erstmaliger Thrombose und Lungenarterienembolie ohne Risikofaktoren ist daher eine Behandlungsdauer von 3-6 Monaten ausreichend.
Nach wiederholten Thromboembolien ist das Rezidivrisiko längerfristig erhöht. Nach erstmaligem Thrombose- bzw. Lungenembolierezidiv sollte daher die Antikoagulation über 12 Monate fortgeführt werden. Wiederholte Rezidive und persistierende Risikofaktoren (z.B. AT III-Mangel, Protein C- oder Protein-S-Mangel) erfordern eine u.U. lebenslange Antikoagulation. [94]
Eine Zusammenstellung der wichtigsten Indikationen und deren übliche Therapiedauer zeigt Tab. 3.
- Vorgehen bei chirurgischen Eingriffen bei bestehender Antikoagulation
Vor einer Zahnextraktion oder anderen kleinen Eingriffen (Tab. 4) kann zwei Tage vor dem Eingriff das Antikoagulans abgesetzt werden, damit die Gerinnungsfähigkeit etwas ansteigt. Danach ist der Quick-Wert zu bestimmen und eine entsprechende Dosierung anzugeben. Wird ein bereits auf Marcumar® eingestellter Patient wegen eines chirurgischen Eingriffs stationär aufgenommen, empfiehlt sich folgende Vorgehensweise (Persönliche Mitteilung Prof. Ohler, Mainz): Die Marcumar®-Behandlung wird in der perioperativen Phase durch die schneller steuerbare Heparinbehandlung abgelöst. Je nach Art der Operation (allgemeines Blutungsrisiko) und Wundheilung (Nachblutungsrisiko) wird die Heparingabe kurz vor der Operation eingeleitet und für einige Tage postoperativ fortgesetzt bis die Wundverhältnisse ein Nachblutungsrisiko nicht mehr erwarten lassen. (Ähnliche Empfehlungen in [13] und [20]). Um eine ausreichende Antikoagulation zu gewährleisten kann als Kreuzungspunkt der Heparin/Marcumarbehandlung und umgekehrt, ein Quickwert von 35-40% angenommen werden.
Schematisiertes Beispiel:
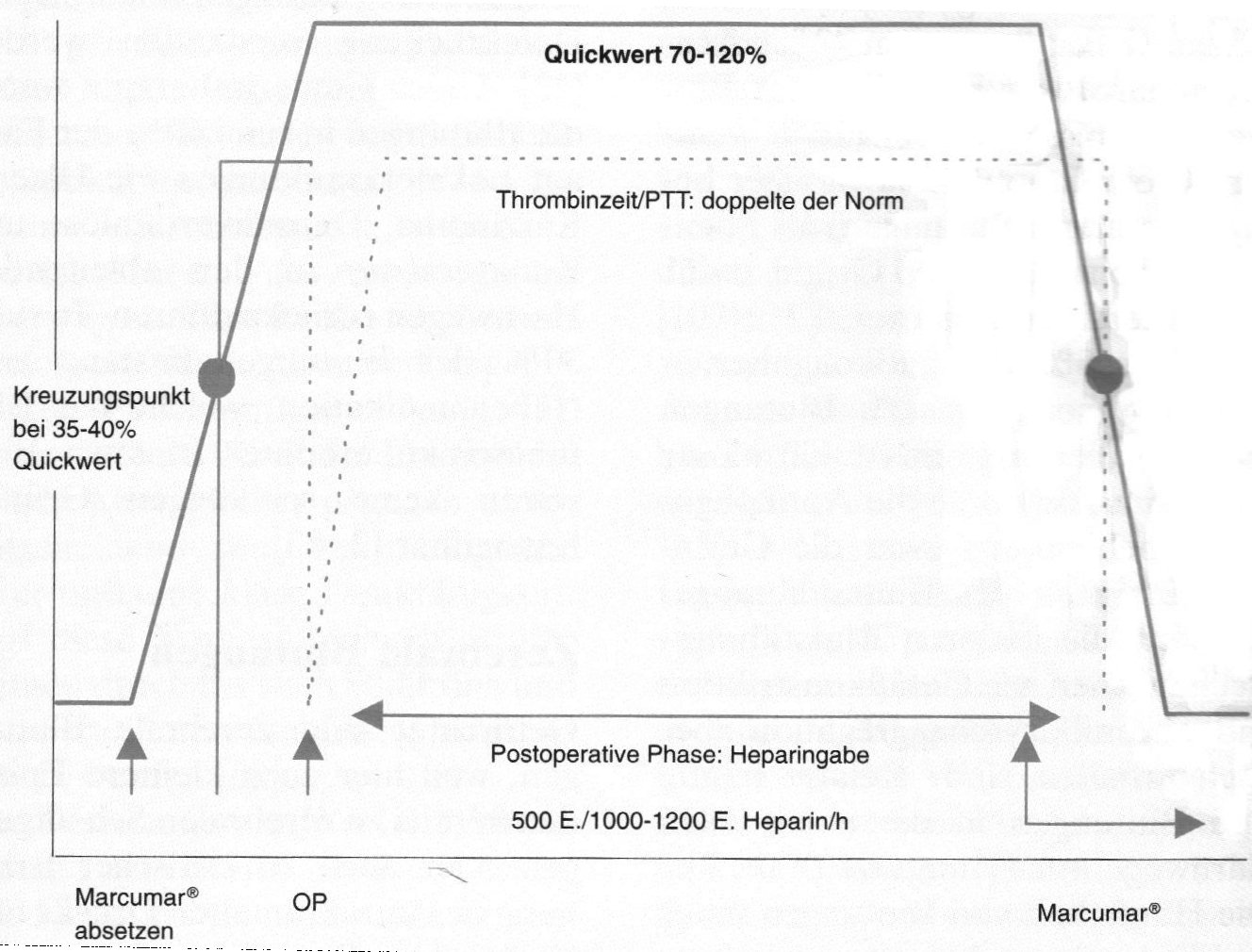
Abb. 3 Perioperative Antikoagulanzientherapie bei vorausgehender Marcumar®-Behandlung.
Mögliches konkretes Therapieregime:
2-5 Tage vor OP Marcumar® absetzen, Quick-Wertkontrolle. Wenn der Quickwert ca. 35% beträgt, beginnt die Heparingabe mit 1000 E/h i.v. Wenn unter dieser Behandlung der Quick-Wert auf über 50- 60% angestiegen ist, ist der operative Eingriff in den meisten Fällen möglich. 2 (-6) Stunden vor der Operation wird die Heparininfusion eingestellt oder auf low-dose reduziert (200-300 E./h). Nach der Operation: alsbald nach Wundverschluß gibt man wieder Heparin mit zunächst 200-500 E. /h i.v. als Dauerinfusion. Falls postoperativ keine Blutung eintritt, kann die Heparindosis am 1. bis 2. Tag wieder auf 1000 - 1200 E. /h als i.v.-Gabe gesteigert werden. Je nach Heilungsverlauf und Nachblutungssicherheit setzt die Marcumar®-Therapie am 5. oder 6. postoperativen Tag (wahlweise auch früher oder später) wieder ein. Man beginnt mit 3 Tabletten pro Tag und Überprüfung des Quick-Wertes. Wenn dann nach 2-3 Tagen ein Wert von 35% erreicht ist, wird die Marcumar®-Behandlung nach Quick-Wertbestimmung fortgesetzt und das Heparin abgesetzt.
Tinker und Tarkan [24] fanden bei Patienten mit Herzklappenersatz, daß nach Absetzen von Warfarin durchschnittlich 2,9 Tage vor einem chirurgischen Eingriff und einer Wiederaufnahme so bald wie möglich (teilweise sogar 7 Tage nach der OP) keine perioperativen thromboembolischen Ereignisse gesehen wurden. Mehrere Studien zu Thromboembolie-Ereignissen haben gezeigt, daß auch der gleichzeitige Beginn von Heparin und Warfarin am Tag 1 sicher und effektiv ist [98].
Eine amerikanische Studie konnten zeigen, daß die frühe Warfarin-Gabe (Tag 1-3 bezüglich der Heparin-Gabe) eine signifikante Verringerung der Hospitalisation bewirkt, was sich in einer Verringerung der Kosten um 1076 $ pro Patient niederschlug. Dies würde eine Kostenersparnis von 86Millionen$ pro Jahr für alle Lungenembolien in den USA ausmachen [120].
Bei schwerer Herzinsuffizienz sind die Dosen vorsichtig zu wählen, da in einer gestauten Leber die Produktion von Gerinnungsfaktoren eingeschränkt sein kann. Im Stadium der Rekompensation und bei Patienten, die nach längerer Bettlägerigkeit wieder mobilisiert werden, kann andererseits eine Erhöhung der Dosen notwendig sein [2].
Neuerdings gibt es beispielsweise in der Herzchirurgie [Persönliche Mitteilung Prof. Oelert Mainz] Bestrebungen, einen Quick-Wert von 30% zu erreichen mit begleitender low-dose Acetylsalicylsäure-Therapie [20, 25]. Voraussetzung ist allerdings eine optimale Therapieführung [86]. Diese Kombination war in der Vergangenheit strikt abgelehnt worden [31]. Es scheint sich allgemein das Vorgehen zu etablieren, nicht mehr einen starren Bereich (also 20-25%) als Korridor zu wählen, sondern zur Minimierung von Blutungskomplikationen den therapeutischen Bereich in Abhängigkeit von der Indikation zu wählen.
- Absetzen
Das Absetzen sollte ausschleichend erfolgen, um der Gefahr einer reaktiven Hyperkoagulabilität vorzubeugen. Man geht dabei schrittweise vor und verringert nach und nach über 3-4 Wochen die Marcumar®-Dosis. Möglicherweise hängt die Hyperkoagulabilität nach abruptem Absetzen damit zusammen, daß es innerhalb der ersten 4 Tage zu einem schnelleren Anstieg der koagulatorisch wirksamen Gerinnungsfaktoren (v.a. VII und IX) kommt, während die antikoagulatorischen Faktoren Protein C und Protein S erst verzögert ansteigen [49, 56].
2.1.5 Nebenwirkungen
Bei den unerwünschten Wirkungen ist zwischen den blutungsbedingten und nicht-blutungsbedingten Wirkungen zu unterscheiden.
Blutungsbedingte Nebenwirkungen (Tab. 6)
Auch die Menstruationsblutung kann verstärkt und verlängert sein. Nur bei außergewöhnlich starken und exzessiv verlängerten Blutungen oder Durchbruchblutungen sollte ein Gynäkologe aufgesucht werden, um eine organische Verletzung auszuschließen [113].
Gastrointestinale und Ulkusblutungen können bei antikoagulierten Patienten besonders schwer verlaufen [1].
- Blutungsrisiken (siehe auch Abb. 7)
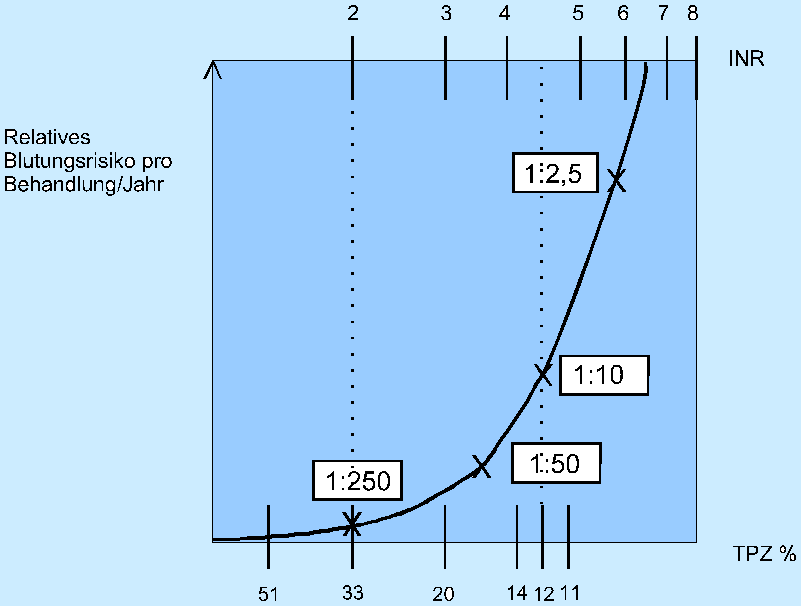
Abb. 7 Zusammenhang zwischen Blutungsrisiko, Thromboplastinzeit (TPZ) und International Normalized Ratio (INR).
Über die Häufigkeit von Blutungskomplikationen unter der Therapie mit Cumarinderivaten gehen die Angaben in der Literatur weit auseinander. Tatsache ist jedoch, daß mit zunehmender Intensität der Antikoagulation die Blutungshäufigkeit stark zunimmt. Es seien daher im folgenden einige wichtige Studien bzw. der allgemeine Tenor für das Blutungsrisiko unter Antikoagulanzien vorgestellt.
In einem Consensuspapier der ACCP/NHLBI (American College of Chest Physicians/National Heart, Lung and Blood Institute) werden folgende Risiken genannt[70, 98]: Das Blutungsrisiko war bei Patienten mit ischämischer cerebrovaskulärer Krankheit und venösen Thromboembolien mit 29% bzw. 23% am höchsten, während die Risiken bei ischämischer Herzkrankheit, protethischen Herzklappen und Vorhofflimmern 23%, 6% und 15% betrugen. Starke Blutungen kamen in 2,4-8,1% vor (ischämische cerebrovaskuläre Krankheit 7%, venöse Thromboembolien 8,1%, ischämische Herzkrankheit 4,7% und prothetische Herzklappen 2,4%). Lebensbedrohliche Blutungen waren am höchsten bei cerebrovaskulärer Krankheit mit 4,8%, bei ischämischer Herzkrankheit 1,0% und bei prothetischen Herzklappen 1,7%. Bei venösen Thromboembolien wurden keine lebensbedrohliche Blutungen gesehen. In einer Veröffentlichung eines holländischen Thrombosedienstes [73] wurden 6814 Patienten, die mit Cumarinderivaten behandelt wurden, einbezogen. Bei 16,5 pro 100 Behandlungsjahren wurden Blutungskomplikationen gesehen, davon waren 13,8 pro 100 Behandlungsjahre schwache und 2,7 pro 100 Behandlungsjahre starke Blutungen. Mit steigendem Alter stieg auch das Blutungsrisiko (32% Erhöhung für alle Blutungen, 46% Erhöhung für starke Blutungen). Jede Erhöhung der INR um einen Zähler erhöhte das Blutungsrisiko allgemein um 54%, für starke Blutungen um 42%. Acenocoumarol war bezüglich der Blutungsereignisse sicherer (26% weniger allgemein und 46% weniger bezüglich starken Blutungen) als Phenprocoumon [73]. Der Grund dafür blieb allerdings unklar.
Bei 3-5% der antikoagulierten Patienten kommt es zu Blutungen [1], die allerdings meist harmloser Natur sind, da durch die Antikoagulanzienbehandlung zwar die Gerinnungsfähigkeit des Blutes herabgesetzt ist, die anderen Blutstillungsmechanismen wie Gefäßkonstriktion und Thrombozytenaggregation aber noch erhalten sind.
Relativ häufig sind Blutungen in die ableitenden Harnwege mit Hämaturie (Tabl. 6).
Die Häufigkeit von Blutungen unter oraler Antikoagulation wird in verschiedenen Studien mit 1-10% angegeben (incl. Hautblutungen). Nach diesen Studien wird die Zahl schwerer Blutungen mit maximal 0,3% angegeben, wobei als schwere Blutungen nur tödliche Blutungen oder Blutungen mit schwerer Defektheilung verstanden werden [42]. Unter Cumarintherapie waren die Blutungen in rd. 60% der Fälle auf Lokalerkrankungen wie Ulcera, Karzinome, Darmdivertikulose und Konkremente in den ableitenden Harnwegen zurückzuführen. In rund 30% der Blutungen bestand eine Nebenmedikation, welche das Blutungsrisiko erhöhte. In ca. 10% waren keine schlüssigen Gründe feststellbar [2, 53].
Gefürchtet sind cerebrale Blutungen, weil hier auch kleinere Episoden bereits zu cerebralen Schädigungen bzw. auch zu kritischer Erhöhung des intrakraniellen Drucks führen können. Bis zu einer PR von 2,0 war die Odds Ratio einer intrakraniellen Blutung kaum größer als 1,0. (Odds Ratio OR von 1,0 bedeutet Durchschnittsrisiko). Oberhalb einer PR von 2,0 (entspricht einer INR von ca. 3,7 bis 4,3 bzw. einem Quick-Wert von ca. 20%) stieg die OR dramatisch an; d.h., der wahrscheinliche Hauptgrund für die intrakranielle Blutung war eine zu intensive Antikoagulation [121]. Ein weiterer signifikanter Risikofaktor war das Alter. Patienten bis zum 65. Lebensjahr hatten eine OR von 1,0. Zwischen 65 und 79 Jahren stieg die OR bei intracerebraler Blutung auf 1,6 und subduraler Blutung auf 3,2 an. Oberhalb des 80. Lebensjahres war jedoch die OR im Hinblick auf intracerebrale Blutungen auf 2,8 und auf subdurale Blutungen auf 5,7 (p=0,006 bzw.0,001) erhöht. Daher sollten vor allem sehr alte Patienten und solche nach Schlaganfall nicht zu intensiv antikoaguliert werden, um das Risiko für intrakranielle Blutungen zu vermindern.
Das Risiko intrakranieller Blutungen ist vor allem bei Alkoholikern und (unzureichend behandelten) Hypertonikern erhöht [94]. Das Risiko einer cerebralen Blutung war bei Patienten mit ischämischen Cerebralgefäßen 29%, bei ischämischer Herzkrankheit 19% und bei Venenthrombosen 73% [106]. Das Risiko intracerebraler oder subduraler Hämatome ist bei über 50jährigen Patienten mit Langzeit-Medikation ca. 10fach erhöht. [89, 122]. Es gilt die Empfehlung, schon bei flüchtigen Rückenschmerzen, anhaltenden oder zunehmenden Kopfschmerzen, an eine intrakranielle Komplikation, insbesondere an cerebrale Mikroblutungen zu denken und das Absetzen des Antikoagulans zu erwägen. Das Risiko wächst mit fortschreitendem Alter und ungenügender Patientenüberwachung [2]. Eine absolute Kontraindikation im hohen Alter gibt es dagegen nicht. Entscheidend sind das biologische Alter und eine klare Denkfähigkeit. Sind diese Voraussetzungen gegeben, können durchaus auch 80-jährige und ältere Patienten langfristig antikoaguliert werden [68]. Retrospektive Studien ergaben: schwere Bltg. bei >65 Jahren, Schlaganfall, gastrointestinalen Blutungen, Vorhofflimmern. Das kumulierte Risiko einer schweren Blutung war 11% nach 12 Monaten und 22% nach 48 Monaten. Studien konnten zeigen, daß mit zunehmendem Alter eine deutliche Zunahme der Blutungshäufigkeit eintritt sowie ein 10fach erhöhtes Blutungsrisiko während des ersten Therapiemonats besteht, im Vergleich zu der Zeit nach dem ersten Therapiejahr.
Die Dosierung von Warfarin beeinflußt klar das Blutungsrisiko. Dies ist der Hauptgrund, daß man in USA seit über 10 Jahren die Mini-Warfarin-Therapie durchführt. Das Risiko einer Blutung steigt mit einer PR >1,5. Paralleltherapie mit Aspirin erhöht das Blutungsrisiko beträchtlich. Mit Dipyramidol scheint kein erhöhtes Risiko zu bestehen. Dieser Wirkstoff sollte daher verwendet werden, wenn eine Thrombozytenaggregationshemmung erwünscht ist (z.B. Patienten mit künstlichen Herzklappen) [98].
Bei Bagatellblutungen wie Nasenbluten, Zahnfleischbluten oder Wundblutungen genügt in der Regel die Anwendung der üblichen blutstillenden mechanischen Maßnahmen (Kompresse, Druckverband, Tampon etc.) ohne daß ein Absetzen des Marcumars® notwendig wäre. Bei mittelschweren Blutungen empfiehlt es sich, das Antikoagulans abzusetzen und/oder durch Vitamin K-Gaben einen Anstieg des Prothrombinkomplexes innerhalb von einem Tag herbeizuführen. Die gewünschte Wirkung wird meist mit 5-10 (-20)Tropfen Vitamin K (Konakion® Tropfen: 1 Tropfen = 1 mg) erzielt [12]. 5 mg Vit. K erhöhen den Quick-Wert nach 24 Stunden um ca. 10% [8]. 25-30 mg führen zur Normalisierung des Quick-Wertes. 25 mg s.c oder i.m. kann die Antikoagulation in 6-12 h aufheben. Patienten, die weiter Antikoagulanzien erhalten müssen, sollten geringere Dosen an Vit. K zugeführt werden (1-5 mg) [90]. (1-5 mg für leichte Überdosierungen, 20-40 mg für schwere Überdosierungen [United States Pharmacopeial Convention Inc. Material Safety Data Sheet, 1990]. 5-15 mg bei leichter Überdosierung, 10-50 mg bei schweren [107]) Vitamin K-Dosen von 25-50 mg machen den Patienten allerdings gegenüber Phenprocoumon ca. 7-14 Tagen resistent und erhöhen das Risiko der Nebenwirkungen [31, 115]. Da die Vit. K-Wirkung mit 5-15 mg i.v. [13] erst nach 24 Stunden das Optimum erreicht, muß bei bedrohlichen Blutungen die Blutstillung neben der Vit. K-Gabe mit Fresh Frozen Plasma (10-20 ml/kg KG)[89] oder durch Prothrombinkomplexpräparate eingeleitet werden (z.B. PPSB, Beriplex®) . Eine Einheit des Komplexpräparates pro Kilogramm Körpergewicht erhöht den Quickwert um 1%. Es gibt keinen signifikanten Unterschied, ob Vitamin K oral oder i.v. gegeben wird [107], die Nebenwirkungen sind jedoch nach i.v.-Gabe höher. Die intravenöse Gabe sollte nicht schneller als 1 mg/Minute gegeben werden, um Nebenwirkungen wie Flush, Brustenge oder Gefäßkollaps zu vermeiden. Bei Patienten, bei denen die Cumarinwirkung aufgehoben wird, die aber weiterhin unter Antikoagulanzien stehen müssen, ist das Thromboserisiko erhöht. Daher muß bei Anhebung des Quick-Wertes über 25% eine niedrig dosierte Heparin-Prophylaxe von ca. 100 E/kg KG/12 h eingeleitet werden [8]. Subkutane und intramuskuäre Injektionen können während einer Therapie mit Antikoagulanzien Hämatome verursachen; sie sind deshalb zu vermeiden. Intravenöse Injektionen bleiben ohne Folgen. Bei leichteren Blutungen muß aber immer das Risiko der Blutung abgewogen werden gegen das Risiko weiterer Thrombosen infolge des angestiegenen Gerinnungspotentials [1].
Nicht blutungsbedingte Nebenwirkungen (Tab. 7)
Gastrointestinale Störungen wie Übelkeit, Erbrechen,
Magendrücken, Diarrhöen sind als seltene Nebenwirkungen beschrieben. Als
Beeinträchtigung der Leber werden passagere
Transaminaseerhöhungen (GOT, GPT)beschrieben. Auch Hepatitisfälle wurden beobachtet
[49, 58,
87, 88].
Störungen des Knochenaufbaus nach Fraktur
(Kallusbildung; Belastungsfähigkeit tritt zu einem späteren Zeitpunkt ein als
bei unbehandelten Patienten [2]) sowie
Haarausfall (Alopecia diffusa) [116] (seltener als nach Heparin, nach Absetzen oft üppiger als vorher
[2]) können auftreten.
Ebenso sind beschrieben
Dermatitis und
Urtikaria, Fieber,
Mundulcera, Anorexia,
Leukopenie, Agranulozytose,
Nephropathie, erhöhte Konzentration an
alkalischer Phosphatase und
Bilirubin.
Offenbar besteht eine Kreuz-Sensibilisierung zwischen den Cumarinderivaten, wie eine Kasuistik [108] nahelegt, bei der eine Patientin makulopapulöse Effloreszenzen mit Pruritus nach Gabe verschiedener Cumarinderivate zeigte.
Bei weniger als 0,1% der Marcumarpatienten [1, 2] kommt es am 2. bis 8. Tag der Antikoagulation zu der gefürchteten Hautnekrose. Frauen sind häufiger betroffen als Männer. Prädilektionsstellen sind Hautpartien mit subkutanen Fettgewebspolstern. Im allgemeinen beginnt die Nekrose als schmerzhafte (druckempfindlich), erythematöse Flecken auf der Haut, die rasch zu dunklen, lividen Flächen konfluieren. Nach etwa 24 Stunden färbt sich das betroffene Gebiet schwärzlich mit scharfer Demarkation zur gesunden Umgebung. Es bilden sich blasige Hautabhebungen und nach 1-2 Wochen ist das betroffene Areal nekrotisch [69]. Die Ursache ist nicht genau bekannt. Es spricht allerdings viel dafür, daß diese Nebenwirkung bei Patienten mit einem Mangel an Protein C vorkommt. Dieser Antigerinnungsfaktor ist ebenfalls Vitamin K-abhängig und sinkt bei einer Phenprocoumonbehandlung rasch ab (Tab. 2), so daß Thrombosierungen der kleinen Gefäße auftreten können. In die so entstehenden kleinen Thromben kann es später, d.h. beim Abfall der Gerinnungsfaktoren, sekundär einbluten. Die Behandlung besteht im sofortigen Stop der Phenprocoumonbehandlung, der anschließenden Gabe von Heparin, um eine herabgesetzte Gerinnung aufrechtzuerhalten. Günstig hat sich auch die anschließende Gabe eines wasserlöslichen Glukokortikoides erwiesen. Zusätzlich kann ein Protein C-Konzentrat (erhältlich in USA oder Immuno Österreich [60]) oder Epoprostenol (Flolan®) versucht werden. Die überlappende Therapie mit Heparin und Phenprocoumon für einige Tage kann offenbar das Risiko einer Cumarinnekrose reduzieren [109]. Möglicherweise besteht bei antikoagulierten Patienten eine höhere Lichtempfindlichkeit mit Rötung und Schwellung sonnenexponierter Hautbezirke [110].
Aus dem HNO-Bereich sind vereinzelt Riechstörungen nach Einnahme oraler Antikoagulanzien berichtet worden [69].
3-8 Wochen nach Therapiebeginn kann das Purple Toe Syndrom beobachtet werden. Die Zehen färben sich purpurn und werden schmerzhaft. Dieses Syndrom geht wohl auf eine Cholesterol- Mikroembolisation zurück. Mehrere Patienten sind bereits an Mirkoembolisation gestorben. Das „Purple Toe-Syndrom" [31] tritt auch ein, wenn das Antikoagulans (hier Warfarin) im therapeutischen Bereich liegt.
Eine Reihe von Erkrankungen oder passageren Zuständen können ebenfalls die Toleranz gegenüber Cumarinderivaten verändern [2]. Beispielsweise kann es zu einer verminderten Toleranz (Hypokoagulabilität) kommen bei:
— Hohes Alter
— Alkoholismus
— Angst
— Kardiale Dekompensation
— Cholezystopathie
— Fieber
— Hyperthyreose
— Hyperventilation
— Hyperzirkulation
— Leberschaden
— Malabsorption
— Röntgentherapie
— Stress
— Unterernährung
— Renale Retention.
Eine erhöhte Toleranz (Hyperkoagulablität) ist möglich bei:
— Adipositas
— Kardiale Rekompensation
— Diarrhö
— Diurese
— Hypothyreose
— Hypozirkulation
— Postoperativer Zustand
— Schock
— Hypoalbuminämie
Bei malignen Erkrankungen ist oftmals eine Hyperkoagulabilität zu verzeichnen, wofür verschiedene Ursachen verantwortlich gemacht werden können (z.B. vermehrte Thromboplastinfreisetzung aus Tumor, Faktor XII-Aktivierung, Interaktion zwischen Thrombozyten und Malignomzellen etc.). Das führt zu einer höheren Inzidenz von rezidivierenden tiefen Beinvenenthrombosen und Lungenembolien bei Tumorpatienten. Eine dann notwendig werdende Antikoagulanzien-Therapie wird durch die beispielsweise Primärlokalisation des Tumors, eine begleitende Chemotherapie und eine evtl. vorhandene Thrombopenie zum Risiko und ist nicht immer durchführbar [68].
Bei Tumorpatienten, die durch Operation, Chemotherapie oder Strahlentherapie erfolgreich behandelt wurden, ist die Antikoagulanzientherapie ohne Einschränkung möglich [68].
Bei Tumoren, die schon per se zu Blutungen führen, ist die Antikoagulanzientherapie dagegen kontraindiziert (siehe Tab. 8).
2.1.6 Indikationen (siehe Tab. 3)
Das Bundesinstitut für Arzneimittel und Medizinprodukte hat folgende Indikationen für Marcumar zugelassen:
Prophylaxe und Therapie von Thrombosen.
Prophylaxe und Therapie von Embolien.
Herzinfarkt.
Dies bedeutet konkret beispielsweise:
— Venenthrombose (Dauer ca. 3-6 [-12] Monate)
— Lungenembolie (6-12 [-24] Monate)
— Vorhofflimmern mit arteriellen Embolien (langfristig) (ist umstritten
[40])
— Herzklappenersatz (unbegrenzt bei künstlicher Klappe, ca. 12 - 24
Wochen bei biologischem Klappenmaterial)
— Hereditärer Antithrombin III-Mangel (längerfristig)
— Herzwandaneurysmen
— Periphere arterielle Verschlußkrankheit (zur Zeit
Thrombozytenaggregationshemmer Mittel der Wahl)
— Aorto-koronarer Bypass (zur Zeit
Thrombozytenaggregationshemmer Mittel der Wahl).
2.1.7 Kontraindikationen (siehe Tab. 9)
Grundsätzlich ist im Einzelfall Nutzen und möglicher Schaden einer Antikoagulanzientherapie gegeneinander abzuwägen. Im weitesten Sinne könnte man von einer Kontraindikation der Antikoagulanzien dann sprechen, wenn schon durch andere Erkrankungen des Patienten eine Blutung oder Blutungsgefährdung gegeben ist. Im einzelnen gelten als Kontraindikationen [1, 2, 55, 111):
Absolut
— Hämorrhagische Diathesen
— Florides Ulcus ventriculi oder duodeni
— Leberparenchymerkrankungen (da Veränderungen der Blutgerinnung
möglich; daher vorher Ausgangsgerinnung testen)
— Hypertension (Fundus hypertonicus > Grad II; unter anhaltender Senkung
durch Antihypertensiva, diastolisch <105 mm Hg, kann eine
Antikoagulanzienbehandlung durchgeführt werden [9])
— Niereninsuffizienz (wegen Gefahr der renalen Retention der
Antikoagulanzien und daraus resultierender Kumulation)
— Frischer Apoplex
— Operative Eingriffe am ZNS und Auge
— Floride Endokarditis
— Floride Tuberkulose
— Retinopathien mit Blutungsrisiko
— Hirnarterienaneurysmen
— Gravidität
— Frische Operationen
Relativ
— Anfallsleiden
— Chronischer Alkoholismus (Gefahr Leberschädigung, Verletzungsgefahr
bei Trunkenheit, schlechte Einstellbarkeit der Patienten)
— Nephrolithiasis
— Mangelnde Intelligenz/Kooperation (Ungenauigkeiten bei Einnahme der
Tagesdosis, Unpünktlichkeit bei Kontrollen erhöht Risiko von Zwischen
fällen drastisch).
— Stillphase
Ist ein invasiver Eingriff geplant, sollte das Nutzen/Risiko-Verhältnis zwischen Blutungsrisiko und Rethrombose abgewogen werden. Angiographien dürfen während einer Behandlung mit Phenprocoumon nicht durchgeführt werden [77].
In der Schwangerschaft ist Phenprocoumon einerseits wegen der
möglichen teratogenen Schädigung, andererseits wegen der Blutungsgefahr kontraindiziert.
Phenprocoumon ist von der amerikanischen FDA in die Kategorie D eingestuft
und somit kontraindiziert aufgrund teratogener Effekte (Chondrodysplasie,
ZNS-Defekte und Unreife [112]; siehe Tab. 10).
Es gibt zwar positive Belege für ein fetales Risko, aber Vorteile in gewissen Situationen (z.B. lebensbedrohliche Situationen oder schwere Krankheiten, bei denen sicherere Arzneimittel nicht verwendet werden können oder ineffektiv sind) könnten für den Einsatz des Arzneimittels sprechen, trotz des bestehenden Risikos. In jedem Einzelfall muß daher das Nutzen/Risikoverhältnis abgewogen werden. Sicher ist es in den allermeisten Fällen erforderlich, anstelle eines Cumarinderivates eine längerfristige Low-dose-Heparinprophylaxe bzw. eine LMWH-Behandlung ambulant durchzuführen.
Phenprocoumon passiert die Plazenta und kann fetale Mißbildungen hervorrufen wie fleckige Knochenentkalkung, Chondrodysplasie (1. Trimester), ZNS-Defekte Optikusatrophie, geistige Retardierung, Katarakte, Mikrocephalie, Mikrophthalmie 2.+3. Trimester) und Frühgeburt. Ferner können fetale Hypoprothrombinämien und Hämorrhagien auftreten. Es kann zum spontanen Abort und Totgeburt kommen [112]. Das Risiko einer potentiellen Schädigung beträgt ca. 30% [1, 65].
2.1.8 Interaktionen (Siehe Tab. 12 und Tab. 13)
Die simultane Verabreichung mehrerer Arzneimittel ist weit geübte Praxis und oft auch notwendig. In einer Erhebung in den USA bekommen die meisten Patienten mehr als 5 Pharmaka gleichzeitig [41]. Zudem nehmen viele Patienten aus eigenem Antrieb weitere Arzneimittel, wie Analgetika, Hypnotika, Erkältungsmittel und andere, ein.
Ein holländischer Thrombosedienst in Den Haag analysierte eine große Anzahl von Blutungszwischenfällen während einer Antikoagulanzien-Therapie. Dabei ergaben sich folgende Ursachen [2]:
— Lokalerkrankungen 54-64%
— Nebenmedikation 23-33%
— Unbekannte Ursachen 13%
Das bedeutet, daß in einem Drittel der Fälle durch verordnete Arzneimittel und/oder durch Selbstmedikation Blutungskomplikationen zu befürchten sind.
Gerade hier liegt eine enorme Chance, durch Beratung über Wechselwirkungen diese Ursache von Nebenwirkungen (Toleranzänderungen) zu minimieren, die Patientencompliance also zumindest auf dem Gebiet der Komedikation bei mindestens jedem 3. Patienten deutlich zu verbessern.
Für die meisten Arzneimittel können Wechselwirkungen beobachtet werden, die sich auf verschiedene Weise manifestieren können. Viele sind dabei klinisch relevant, d.h., die gegenseitige Beeinflussung kann zu unerwünschten Effekten führen und teilweise dramatische Konsequenzen haben. Gerade für Antikoagulanzien kann eine solche Relevanz ausgesprochen werden, gerade auch deshalb, da viele Patienten die Antikoagulanzien teilweise über längere Zeit oder lebenslang nehmen müssen. Ferner ist die präzise Wirkintensität für die Antikoagulanzien unentbehrlich. Daher können Interaktionen mit Antikoagulanzien auch relativ leicht entdeckt und analysiert werden.
Die Mechanismen der Interaktionen betreffen im wesentlichen
— Reduzierte Vitamin K-Verfügbarkeit,
— Reduzierte Antikoagulanzien-Resorption,
— Änderungen der Antikoagulanzien-Proteinbindung,
— Beeinflussung des Antikoagulanzien-Metabolismus,
— Änderungen in der Antikoagulanzien-Rezeptoraffinität,
— Reduktionen der Vitamin K-abhängigen Gerinnungsfaktoren,
— Andere Effekte (Rezeptoraffinität der Antikoagulanzien)[32, 90].
Tabelle 12 nennt die Arzneimittel, für die eine Erhöhung der Phenprocoumon-Wirkung beschrieben ist und somit eine erhöhte Blutungsgefahr besteht.
Tabelle 13 nennt die Arzneimittel, für die eine Verringerung der Phenprocoumon-Wirkung beschrieben ist und somit eine erhöhte Thrombosegefahr besteht.
Das Risiko ernsthafter Blutungen als Ergebnis von Arzneimittel-Interaktionen mit Antikoagulanzien kann minimiert werden durch Vermeiden dieser Arzneimittel. Sollte trotzdem ein Arzneimittel notwendig werden, muß sowohl zu Beginn als auch beim Absetzen dieses Arzneimittels durch engmaschige Kontrolle der Prothrombinzeit überprüft werden, welche Dosiskorrekturen notwendig werden [32].
Die Interaktionen von Phenprocoumon mit anderen Arzneimitteln lassen sich praktischerweise einteilen in blutungsgefährdende und thrombosegefährdende (Tab. 12 und 13).
Im folgenden sollen einige klinisch relevante Ineraktionen erläutert werden:
Fälle von Fett-Malabsorption (geringe Resorption von Vitamin K) können die Anwort auf Antikoagulanzien drastisch verstärken. Möglicherweise sind die Effekte von Arzneimitteln auf die Resorption von Antikoagulanzien geringfügig bzw. heben sich insofern auf, als die Resorption von Vitamin K auch entsprechend gestört ist [41].
Da Phenprocoumon zu einem sehr hohen Prozentsatz an Albumin
gebunden ist, macht sich auch schon eine geringfügige Verdrängung und
Freisetzung an den Bindungsstellen deutlich bemerkbar. Phenprocoumon wird
zu ca. 99% an Albumin gebunden; eine Freisetzung von nur 1%
verdoppelt bereits den freien Anteil von Phenprocoumon. Arzneimittel mit
hoher Affinität zu den Albuminbindungsstellen können den
freien Antikoagulanzienanteil ganz beträchtlich erhöhen und eine
schwere Hypoprothrombinämie und Blutungen auslösen [41].
Die Verstärkung der Hypoprothrombinämie ist aber nicht der
alleinige Effekt der Konkurrenz mit den Albuminbindungsstellen. Der höhere
freie Anteil führt zu einer höheren Verfügbarkeit der Antikoagulanzien in
der Leber und zur glomerulären Filtration. Verdrängung bedeutet eine
Erhöhung der Raten der metabolischen Inaktivierung und renaler
Clearance und verkürzt ihre Plasmahalbwertszeit. Der Anteil der
Antikoagulanzien, der täglich entfernt wird, übersteigt dann die tägliche Einnahme, so daß
es langsam zu einer Senkung der totalen Plasmakonzentration führt [41].
Dieser Abfall der Plasmakonzentration geht so lange, bis der freie
Anteil an Antikoagulanzien im Plasma den ursprünglichen Level vor der
Einnahme des Konkurrenz-Arzneimittels erreicht hat, die Elimination wieder
der Einnahme entspricht und ein neuer Steady-state erreicht wird.
Fazit: Eine Verdrängung eines Antikoagulans aus seinen
Albuminbindungsstellen erhöht den freien Anteil des Antikoagulans, verstärkt
die Hypoprothrombinämie und verkürzt die
Antikoagulanzien-Halbwertszeit. Diesen Effekten folgt ein zunehmender Abfall in der totalen und
freien Antikoagulanzien-Konzentration im Plasma und eine allmähliche
Verringerung der Hypoprothrombinämie. Der Steady-state der Interaktion
ist charakterisiert durch eine geringere totale
Antikoagulanzien-Plasmakonzentration, durch dieselbe freie Konzentration und durch
denselben Grad der Hemmung der Prothrombinkomplexsynthese wie vor der
Verabreichung des verdrängenden Arzneimittels [41].
Die Zeit bis zur Kumulation des verdrängenden Arzneimittels,
die Halbwertsezeit des Antikoagulans in Gegenwart des
verdrängenden Arzneimittels und die Halbwertszeit der Vitamin
K-abhängigen Gerinnungsfaktoren sind bestimmend für die Zeitspanne
zwischen derVerstärkung der Hypoprothombinämie und ihrem allmählichen
Nachlassen [41].
Wird der stark an das Albumin gebundene und das Antikoagulans
verdrängende Wirkstoff abgesetzt, wird die Wirkung der Antikoagulanzien auf
den Prothrombinkomplex nicht oder nur wenig beeinflußt, da die
feste Albuminbindung nur allmählich abnimmt [41].
- Diurese
Die verstärkte Synthese der Gerinnungsfaktoren nach Beseitigung einer Leberstauung durch Diuretika ist wahrscheinlich die Ursache für eine milde Resistenz gegenüber Antikoagulanzien bei Patienten mit Herzinsuffizienz. Durch Entzug von Plasmawasser können Diuretika über eine Hämokonzentration zu einer Erhöhung der Gerinnungsfaktoren und dadurch zu einer Verringerung der Antikoagulanzienwirkung führen.
Die Enzyminduktion erhöht denStoffwechsel der Antikoagulanzien, verkürzt die Plasma-Halbwertszeit und verringert die totale und freie Plasmakonzentration. Das Ausmaß der Enzyminduktion läßt sich an der Veränderung der Halbwertszeit ersehen. 2-5 Tage einer Barbituratgabe können den Metabolismus der Antikoagulanzien deutlich beschleunigen und damit ihre hypoprothrombinämische Wirkung antagonisieren [43]. Statt Barbituraten können im übrigen Benzodiazepine empfohlen werden, für die keine Interaktionen mit Antikoagulanzien bekannt sind.
Im Gegensatz zu den Stoffen, die eine Enzyminduktion bewirken, stehen Substanzen, die die Metabolisierung der Antikoagulanzien vermindern, deren Plasmakonzentration erhöhen und die Hypoprothrombinämie verstärken. Hierbei muß die Antikoagulanzien-Erhaltungsdosis reduziert werden, um eine massive Hypoprothrombinämie und Blutungen zu vermeiden. Arzneimittel können die metabolische Inaktivierung von Antikoagulanzien verlangsamen durch Hemmung der Synthese von Antikoagulanzien-metabolisierenden Enzymen, durch Hemmung ihrer Aktivität oder durch Konkurrenz bei der Biotransformation durch dasselbe Enzym-Cofaktorsystem. Eine solche Interaktion kann sich bereits nach einigen Stunden bemerkbar machen [41].
- Einfluß auf Gerinnungsfaktoren
Eine hepatische Dysfunktion sowie hypermetabolische Situationen (z.B. durch Schilddrüsenhormone) durch Fieber oder Hyperthyreoidismus können die Anwort auf Antikoagulanzien drastisch verstärken, wahrscheinlich durch Katabolismus der Vitamin K-abhängigen Gerinnungsfaktoren [32]. Umgekehrt können Thyreostatika die Empfindlichkeit von hyperthyreoten Patienten vermindern. Wirkstoffe, die das Ausmaß einer Hypoprothrombinämie durch Antikoagulanzien verändern ohne in die Pharmakokinetik von Vitamin K oder der Antikoagulanzien einzugreifen, wirken wahrscheinlich durch Beeinflussung der Konzentration der Gerinnungsfaktoren, entweder durch Beeinflussung der Synthese oder deren Katabolismus oder beides [41]. Arzneimittel, die die Hypoprothrombinämie verstärken, können dies auch über die direkte Antikoagulanzien-ähnliche Weise tun, nämlich durch Antagonisieren der Vitamin K-Wirkung. Für Salicylate bespielsweise ist dieser Effekt bekannt, der auch durch hohe Dosen Vitamin K aufgehoben werden kann [41].
- Prostaglandinsynthesehemmung
Viele Arzneimittel, die mit den Antikoagulanzien in bezug auf die Herabsetzung der Prothrombinkonzentration in Wechselwirkung treten (ASS, Clofibrat, Mefenaminsäure), interagieren auch mit dem normalen Plättchenfaktor , oder sie verursachen Mikroblutungen oder Magenulzerationen (z.B. Acetylsalicylsäure). Solche Arzneimittel können ernsthafte Blutungen bei Antikoagulanzien-behandelten Patienten hervorrufen, deren Quick-Wert im gewünschten Bereich liegt.
Als Schmerzmittel sollte Paracetamol dem ASS vorgezogen werden, da für Paracetamol keine Beeinflussung der Antikoagulanzien-Wirkung beschrieben ist [43]. Auch Ibuprofen als einziges aus der Gruppe der nicht-steroidalen Antiphlogistika kann eingesetzt werden.
Cephalosporine mit Methylthiotetrazolgruppe (Cefazolin und Cefazedon)
haben einen ähnlichen Effekt [38] wie die Antikoagulanzien.
Methylthiotetrazole hemmen die Carboxylase und
die Epoxidreduktase. Bei gesunden Personen tritt diese Nebenwirkung nicht
auf. Risikofaktoren sind dagegen Niereninsuffizienz, keine orale
Ernährung, Krebs [38].
Lipsky [45] konnte zeigen, daß die abgespaltene Seitenkette
N-Methyl-thiotetrazol ähnlich wie die Antikoagulanzien das
Enzym für die Carboxylierungsreaktion hemmt. Möglicherweise trifft
dies auch auf die strukturell ähnliche Seitenkette, wie beim
Ceftriaxon zu [45]. Eine neue Studie fand heraus [46], daß durch die
N-Methyl-thiotetrazol-Seitenkette nicht nur die Reduktion des Vitamin
K-2,3-epoxids und des oxidierten Glutathions gehemmt wird,
sondern oxidiertes Glutathion auch die mikrosomale Reduktion der
Vitamin K-2,3-epoxide hemmt. Die hepatische Metabolisierung von
N-Methyl-thiotetrazol führt also zur Anreicherung von oxydiertem
Gluathion, das damit nicht zur Reduktion der Epoxide zur
Verfügung steht und es somit zu einer Verstärkung
der Hypoprothrombinämie bei antikoagulierten Patienten kommt.
Fazit (siehe auch Abb. 6):
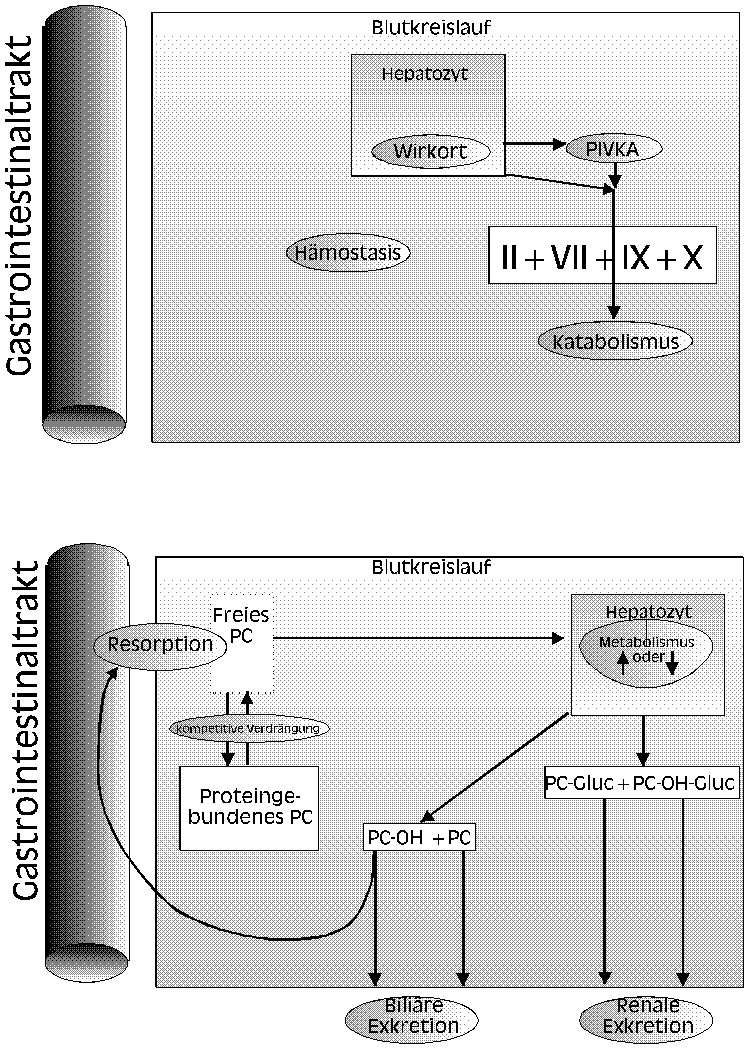
Abb. 6 Beispiele für pharmakodynamische Interaktionen (keine
Veränderungen des Antikoagulanzienlevels): Wirkort (Vitamin K), Synthese der
Gerinnungsfaktoren (Steroide), Gerinnungsfaktor-Katabolismus (Thyroxin),
hämostatischer Prozeß (Acetylsalicylsäure).
Beispiele für pharmakokinetische Interaktionen (kinetische Veränderung
des Antikoagulanzienlevels): Resorption (Cholestyramin),
Plasmaproteinbindung (nichtsteroidale Antiphlogistika), Metabolismus erhöht (Barbiturate),
Metabolismus reduziert (Metronidazol), veränderte Exkretion (Kontrazeptiva). Modifiziert
nach [90].
Patienten, die neben Phenprocoumon noch andere
Arzneimittel erhalten, die die Verfügbarkeit von Cumarinen herabsetzen und
die Metabolisierung der Cumarine steigern, benötigen also eine
höhere Phenprocoumon-Dosis, damit eine ausreichende
Antikoagulation sichergestellt ist. Es ist wichtig, die Cumarindosis zu
reduzieren, wenn zusätzliche Arzneimittel, welche die Wirkung
abschwächen, abgesetzt werden. Anderenfalls erreicht man zu hohe
Cumarin-Konzentrationen und es besteht somit Blutungsgefahr.
Im umgekehrten Sinne ist zu verfahren, wenn gleichzeitig
die Verfügbarkeit von Vitamin K herabgesetzt ist bzw. parallel
zu Cumarinen Arzneimittel verabreicht werden, die ihre
Wirkung abschwächen.
Grundsätzlich gilt, daß jede Änderung einer kombinierten
Therapie mit dem Risiko einer Interaktion behaftet ist, so daß die
Patienten durch häufige Kontrollen in den Übergangszeiten zu
überwachen sind.
Selbstverständlich muß bei klinisch relevanten Interaktionen
nicht nur bedacht werden, daß Veränderungen des
Phenprocoumon-Spiegels auftreten, sondern auch entsprechende
Komplikationen durch Veränderungen des interagierenden Arzneistoffes
berücksichtigt werden müssen, z.B. Phenprocoumon bei einem
mit Glibenclamid eingestellten Diabetiker. [31]
Tab.14 schließlich nennt Arzneimittel, für die definitiv keine Interaktionen mit Antikoagulanzien festgestellt wurden.
2.1.9 Intoxikation
Das klinische Bild einer akuten Überdosierung zeigt abhängig vom Ausmaß der Intoxikation im wesentlichen Hämaturie, petechiale Blutungen an Stellen mechanischer Belastung, spontane Haut- und Schleimhautblutungen, Melaena, Verwirrtheitszustände bis hin zur Bewußtlosigkeit. Innerhalb der ersten 24 Stunden nach Ingestion größerer Mengen steht die Kapillarwirkung im Vordergrund.
Die gastrointestinale Resorption läßt sich durch Gabe von Colestyramin oder Carbo medicinalis hemmen. Auf dieselbe Weise kann der enterohepatische Kreislauf der glucuronidierten Metaboliten unterbrochen werden. Die Plasma-Halbwertszeit läßt sich dadurch etwa um die Hälfte verringern [2]. Da Phenprocoumon dialysierbar ist, kann auch eine extrakorporale Dialyse erwogen werden.
— Patienten, die nicht mit Antikoagulanzien behandelt wurden und akzidentell oder in suicidaler Absicht hohe Dosen eingenommen haben, können zum Erbrechen gebracht werden, am effektivsten innerhalb 30 Minuten nach Einnahme.
Ipepcauanha-Sirup: Erwachsene 30 ml, Kinder (1-12 Jahre) 15 ml.
Die amerikanische FDA empfiehlt [12] 30 g Aktivkohle in 240 ml Wasser.
Normaldosis ist 30-100 g bei Erwachsenen und 15-30 g bei Kindern (0,5-1-2 g/kg KG).
Anschließend mit salinischen Mitteln abführen. Bestimmung des Quick-Wertes
und Gabe von FFP (Fresh Frozen Plasma) und PPSB.
Vitamin K-Gabe 1-5 mg i.m. bei Kindern, 10 mg i.m. bei Erwachsenen.
Normalerweise orale Gabe, bei schweren Vergiftungen i.v. Gabe.
In lebensbedrohlichen Fällen Bluttransfusion.
— Patienten, die antikoaguliert wurden:
Die FDA empfiehlt auch hier 30 g Aktivkohle in 240 ml Wasser (siehe oben).
Emesis und Magenspülung sollten vermieden werden, um eine potentielle
Verletzung und daraus folgende Blutung zu verhindern.
Der Quick-Wert wird bestimmt und FFP verabreicht.
Die Vitamin K-Gabe kann für Patienten mit einer absolut notwendigen
Antikoagulation gefährlich werden. Bei lebensbedrohlichen Blutungen kann
man Vitamin K zusammen mit Heparin geben.
Auch an Bluttransfusionen muß gedacht werden.
Die Literatur zu den Indikationen der gerinnungshemmenden Therapie ist umfangreich und keineswegs in allen Punkten einheitlich. Nachfolgend werden einige wesentliche Krankheitsbilder angeführt, wobei die Behandlungsempfehlungen eine Mehrheitsauffassung von Autoren wiedergibt, ohne daß diese im einzelnen genannt werden sollen.
Es gibt inzwischen eine große Anzahl klinischer Studien, die deutlich die Effektivität der Antikoagulanzien gezeigt haben. Antikoagulanzien sind effektiv in der primären und sekundären Prävention der venösen Thromboembolien, in der Prävention der systemischen Embolie bei Patienten mit prothetischen Herzklappen oder Vorhofflimmern und in der Prävention des Schlaganfalls, Infarktrezidiv und des Todes bei Patienten mit akutem Myokardinfarkt [91]. Meistens ist eine INR von 2,0-3,0 angebracht [32].
— Prävention der Venenthrombosen
Viele Studien zeigen die Wirksamkeit oraler Antikoagulanzien in der Prävention der Venenthrombosen mit einer Hüftgelenks-OP [40] und größeren gynäkologischen Operationen mit einem INR-Bereich von 1,5-3,0 [32]. Normalerweise verwendet man die Antikoagulanzien nur bei Hochrisikopatienten, z.B. solchen mit früheren Venenthrombosen oder solchen mit früheren größeren orthopädischen Eingriffen [32] oder nach einem Myokardinfarkt [40].
Zur Verhütung venöser thromboembolischer Komplikationen sollten Patienten bei Hüftgelenksoperationen oder anderen Operationen mit hohem Risiko prophylaktisch mit Antikoagulanzien behandelt werden, wobei eine INR von 2,0-3,0 angestrebt wird [70].
— Behandlung der tiefen Venenthrombosen
Bei proximalen tiefen Beinvenenthrombosen antikoaguliert man für ca. 3-6 Monate. Hier zeigte sich eine moderate Antikoagulation von INR 2,0-2,3 als genauso effektiv aber mit deutlich geringerer Blutungshäufigkeit, wie eine intensivere Antikoagulation mit INR 2,5-4,1 [32]. Auch in einem Consensus-Papier von 1986 [70]empfehlen die Autoren bei venösen Thromboembolien eine Antikoagulation für 3 Monate bei einer INR von 2,0-3,0. Patienten mit rezidivierenden venösen Thrombosen oder einem Risikofaktor wie AT III-Mangel, Protein C-Mangel sollten lebenslang antikoaguliert werden.
Tiefe Thrombosen findet man in der Schwangerschaft in einer Häufigkeit von 0,1-0,3% [68]. Im Wochenbett dagegen werden Zahlen von 0,15%-1% angegeben, die phlebographisch gesichert sind. Der Zeitpunkt der klinischen Diagnose der Schwangerschaftsthrombose liegt bei 17% der Erkrankten im ersten Trimenon, bei 30% im 2. Trimenon und bei 53% im letzten Trimenon [68]. Allerdings sind die Cumarine bei Schwangerschaftsthrombosen kontraindiziert. Hier ist Heparin das Antikoagulans der Wahl [68]. Dies gilt auch für Patientinnen mit Klappenprothese.
Neben der tiefen Beinvenenthrombose sind es v.a. die thrombogenen Krankheiten der Herzkranzgefäße, des Myometriums und der Herzklappen, bei denen sich eine Antikoagulation durchgesetzt hat.
Der Myokardinfarkt ist ein besonders thrombogenes Geschehen. Kurz nach
dem Infarkt sind bei 17-46% murale Thromben vorhanden, 10% haben meist
cerebrale Thromben. Die nach Myokardinfarkt nicht seltenen Herzaneurysmen weisen in
50-100% Thromben auf. Die Emboliehäufigkeit beträgt 10%.
Beinvenenthrombosen und Lungenembolien sind ebenfalls nicht selten [91].
Frühe Studien in den 60er und 70er Jahren haben gezeigt, daß eine
moderate Antikoagulation (INR 2,0) wirksam war in der Prävention des Schlaganfalls und
der Lungenembolie bei Patienten mit akutem Myokardinfarkt.
Eine Metaanalyse von 5 großen kontrollierten klinischen Studien ergab [36],
daß mit Antikoagulanzien (hier Warfarin) bei Patienten mit Vorhofflimmern das
Risiko für einen Schlaganfall um 68% gesenkt werden kann.
Eine andere Metaanalyse von 7 Studien zeigte, daß die Gabe von
Antikoagulanzien für 1-6 Jahren die Mortalität und einen Reinfarkt um ca. 20% reduzierten.
Zwar ist der Nutzen der Antikoagulanzien-Therapie nach Myokardinfarkt
immer noch umstritten, doch gibt es Studien, welche zeigen, daß die Inzidenz
cerebraler Embolien von 5% auf 1% und pulmonalen Embolien von 20% auf 10%
gesenkt werden kann.
Zur Prophylaxe des Reinfarktes kann eine Langzeit-Antikoagulation
eingesetzt werden [61]. Die Mortalität wird um 50% (im Mittel von 10,4% auf 6,1%),
die Reinfarktrate von 12,9% auf 5% gesenkt [1, 91].
Die Autoren der Consensus-Veröffentlichung [70] empfehlen bei Myokardinfarkt-Patienten mit erhöhtem Embolierisiko (z.B. Vorhofflimmern oder vorausgegangener Lungenembolie) eine Antikoagulation für mindestens 3 Monate mit einer INR von 2,0-3,0.
Eine Studie mit Cumarinderivaten ergab geringere thromboembolische
Komplikationen (60-79% geringeres Risiko) als mit Thrombozytenaggregationshemmern.
Die Blutungshäufigkeit war allerdings höher. Eine andere Studie verglich eine
Antikoagulation mit INR 2,0-2,3 mit einer Antikoagulation von INR 2,5-4,9. Auch
hier zeigte sich der Vorteil einer moderaten Antikoagulation: Bei gleicher
Effektivität zeigte sich eine geringere Anzahl Blutungen [33].
Zu dem selben Ergebnis kam eine weitere Studie, die eine Gruppe mit
einer INR von 7,4-10,8 mit einer anderen Gruppe (INR 1,9-3,6) verglich.
Wieder eine andere Studie verglich Patienten mit prothetischen
Herzklappen und einer INR von 9 gegen eine INR von 2,65. Auch hier wurde bezüglich
der Verminderung von Thromboembolien gefunden, daß die
niedrigere Antikoagulanzien-Dosis völlig ausreicht. Die höhere Antikoagulation
brachte lediglich ein höheres Blutungsrisiko [44]. Bei gleicher Effektivität traten in der ersten Gruppe erheblich häufiger Blutungen auf. [34].
Grundsätzlich gilt, daß Aortenprothesen weniger Thromben verursachen,
als Mitralprothesen. Die Autoren des Consensus-Komitées [70] empfehlen
daher auch keine Langzeit-Antikoagulation. Mechanische Ventile sind
mehr thrombosegefährdet als Bioprothesen. Je nach Modul findet man bis zu
27% Embolien, die durch Antikoagulation bis 4-5% gesenkt werden können.
Turpie et al. [25] überprüften in einer placebokontrollierten Multicenterstudie mit Risikopatienten (mechanischem Klappenersatz, Bioprothesen und Vorhofflimmern oder Thromboembolieanamnese) die Wirksamkeit von Antikoagulanzien mit und ohne Acetylsalicylsäure (ASS) 100 mg täglich. In der Gruppe mit ASS fand sich gegenüber der Gruppe mit nur Antikoagulanzien eine deutlich geringere jährliche Letalität (2,8% vs. 7,4% pro Jahr) und weniger große Thromboembolien (1,6% vs. 4,6% pro Jahr). Insgesamt traten bei dieser Studie thromboembolische Ereignisse oder vaskuläre Todesfälle bei den zusätzlich mit ASS behandelten Patienten sehr viel seltener auf (1,9% vs. 8,5%, Risikoreduktion 77%). Beeindruckend sind vor allem die Ergebnisse bei den besonders gefährdeten Subpopulationen: nach multiplem Klappenersatz (5,3% vs. 17,6%) nach Mitralklappenersatz (3,8% vs. 17,1%), präoperativ bestehendem Vorhofflimmern (2,4% vs. 18,1%) und nach mechanischem Klappenersatz (2,8 vs. 14,3%)[25].
Das Consensus-Papier von 1986 [70] empfiehlt bei Patienten mit mechanischem Herzklappenersatz eine INR von 3,0-4,5 anzustreben. Patienten mit Bioprothesen werden für 3 Monate antikoaguliert mit einer INR von 2,0-3,0. Hochrisikopatienten (systemische Embolien, Vorhofflimmern) mit Bioprothesen müssen dagegen Langzeit-antikoaguliert werden [70].
Sobald eine Schwangerschaft eingetreten ist, sollten Patientinnen mit Herzklappen mit Heparin (hier auch LMWH s.c.) bis zur Geburt des Kindes antikoaguliert werden [70].
— Vorhofflimmern (Siehe auch Tab. 14)
Vorhofflimmern findet sich bei 0,4% aller Erwachsenen. Die Häufigkeit
nimmt mit dem Alter zu und erreicht für die Gruppe der über 60jährigen 2-4% [57].
Der häufigste Klappenschaden ist die Aorteninsuffizienz. Sie kann
eine Ventrikeldilatation verursachen. Seltener sind Mitralvitien, meist
rheumatischer Natur, mit Stenose und/oder Insuffizienz. Sie führen zur Dilatation des
linken Vorhofes. Mit dem bei Vorhofdilatation auftretenden Vorhofflimmern
übersteigt das Thromboserisiko 50% und die Emboliehäufigkeit im großen
Kreislauf beträgt 20-30%.
Durch Antikoagulanzien-Therapie kann die Emboliefrequenz von 25% auf
1% resp. von 27% auf 3% reduziert werden.
Auch Vorhofflimmern nichtrheumatischer Natur, z.B. bei der KHK oder
bei Bouveret-Syndrom (paroxysmale Tachykardie), birgt ein sehr
hohes Thromboembolierisiko in sich. Das Risiko für einen ischämischen
Schlaganfall ist etwa 4-5fach höher [29, 37]. Nichtrheumatisches Vorhofflimmern,
besonders mit Mitralstenose, gilt allgemein als Disposition für systemische
Embolien [37, 40, 61].
Bei Vorhofflimmern infolge Mitralvitien sollte lebenslänglich antikoaguliert werden [61]. Angestrebt wird ein INR von 2,0-3,0 [70].
Die SPAF-Studie [26] zeigte deutlich, daß die Risiken von Patienten mit Vorhofflimmern (ischämischer Schlaganfall, systemische Thromboembolie) durch Antikoagulanzien (hier Warfarin) signifikant gesenkt werden konnte. Das Placebo-kontrollierte Risiko (7,4%/Jahr) konnte mit Warfarin auf 2,3%/Jahr gesenkt werden. Dabei zeigte sich, daß die niedrig dosierten Antikoagulanzien (INR 1,5-2,7) mit ca. 30-50% Quick-Wert sich als genauso effektiv erwiesen wie die hoch dosierten [28].
Dauermedikation mit Chinidin erhält zwar in einem höheren Prozentsatz den Sinusrhythmus, doch liegt die Mortalität in der Behandlungsgruppe deutlich höher [27]. Mit wachsender Zurückhaltung bei der antiarrhythmischen Langzeittherapie gewinnt die Antikoagulation auch für Patienten mit Vorhofflimmern an Bedeutung.
Auch aus der SPINAF-Studie [71] kann man eine Empfehlung zur Low-dose-Antikoagulation bei Vorhofflimmern ohne rheumatische Klappenvitien ableiten. Hier wurden Patienten mit Warfarin (INR 1,4-2,8 ca. 30-55% Quick-Wert) behandelt, wobei eine Risikoabnahme, einen Schlaganfall zu bekommen, von 79% gefunden wurde.
3 randomisierte Studien haben gezeigt, daß eine Antikoagulation sowohl den
Schlaganfall als auch systemische Embolien bei Patienten mit nichtrheumatischem
Vorhofflimmern senkt.
In der ersten mit relativ hohen INR-Werten von 2,8-4,2 war die Antikoagulation
signifikant effektiver als Aspirin oder Placebo, allerdings mit erhöhtem Blutungsrisiko.
Die 2. Studie [26] erreichte geringere INR-Werte (1,8-3,4). Auch hier war die
Reduzierung des Rsikikos (einen Schlaganfall oder systemische Embolien zu bekommen)
mit 81% eindrucksvoll geringer als in der Placebogruppe.
Eine weitere Studie [28] arbeitete mit INR 1,5-2,5 und ergab eine Risikoreduktion von 86% und keinen klinisch bedeutsamen Blutungen in der Antikoagulanzien-Gruppe (hier Warfarin).
— Sonstige
Die Therapie der Arteriellen Verschlußkrankheit (AVK) mit Thrombozytenaggregationshemmern stellt sicher geringere Anforderungen an die Compliance des Patienten. Auch sind mögliche Blutungen i.a. weniger gefährlich als unter einer Antikoagulanzien-Therapie. Allerdings ist der Anteil der Patienten, die die Behandlung mit Thrombozytenaggregationshemmern wegen Unverträglichkeitserscheinungen (insbesondere von seiten des Gastrointestinaltraktes) abbrechen, im allgemeinen größer als bei der Antikoagulanzien-Therapie [1].
Eine europäische Studie [30] untersuchte Patienten mit
transitorischen ischämischen Attacken und leichterem Schlaganfall placebokontrolliert mit
Antikoagulanzien (Cumarinderivate).
Das Ergebnis war, daß 8%/Jahr der mit Antikoagulanzien behandelten Patienten
Schlaganfall, Herzinfarkt oder Embolien bekamen im Gegensatz zu 17%/Jahr der mit
Placebo behandelten. Die Consensus-Autoren [70] empfehlen noch keine Antikoagulation
bei diesen Patienten. Bei vorausgegangenen Embolien und auch bei rheumatischem
Klappenfehler soll der Quick-Wert auf 25-35% eingestellt werden. Für besonders
gefährdete Patienten mit Herzinsuffizienz oder Bluthochdruck wird unter Abwägung des
Nutzen-Risikos eine niedrigere Antikoagulation (30-50%) empfohlen.
Ein weiteres Krankheitsbild mit hochgradiger Thromboseneigung ist das relativ selten vorkommende Antiphospholipid-Antikörper-Syndrom (AAS) [75], oft assoziiert mit einem systemischen Lupus erythematodes. Die Ergebnisse einer Studie mit AAS-Patienten zeigen einmal mehr, daß der Grad der Antikoagulation bei hoher Thromboseneigung von großer Bedeutung ist für den Erfolg der Therapie. Das AAS ist ein Beispiel dafür, daß eine Low-dose-Antikoagulation nicht angebracht ist. Solche Patienten müssen eine intensive Antikoagulation bekommen (INR >3), um ein günstiges Effektivität/Risiko-Verhältnis zu erreichen.
Der zweite Teil dieses Artikels berichtet über die praktischen Aspekte unseres für die Universitätskliniken Mainz eingerichteten Konsiliardienstes für Marcumar®-Patienten.
Aspekte der Patientenberatung
1.1 Beratung von Patienten, die mit oralen Antikoagulanzien therapiert werden; Vorbereitung einer Patientenberatung
Nachdem im ersten Teil Pharmakologie und Klinik der Antikoagulanzien, speziell von Phenprocoumon abgehandelt wurde, widmen wir uns jetzt den darauf fußenden praktischen Folgerungen, wie wir sie in die Tat umsetzten und wie wir den etablierten Konsiliardienst an den Universitätskliniken durchführen.
Auf Station sollte man sich zuerst anhand der Krankenakte sämtliche relevanten Informationen zum Patienten heraussuchen und schriftlich festhalten. Dazu haben wir ein Formular „Patienten-Medikationsprofil" entwickelt, in dem die persönlichen Angaben des Patienten, die Diagnose, ggf. der operative Eingriff bzw. der Grund für eine Marcumarisierung und die vorgesehene Dauer sowie der zu erreichende Quick-Wert (besser INR-Wert!) eingesetzt werden. Die prästationäre, die stationäre und poststationäre Medikation wird sodann erfaßt. Natürlich wird auch der nach Entlassung des Patienten betreuende Hausarzt mit Anschrift notiert, um später eventuell eine Nachfrage über den Verlauf der Therapie des beratenen Patienten zu ermöglichen. Angaben des beratenden Apothekers mit Datum und Unterschrift komplettieren dieses Formular. Ebenso wird dann ein Merkblatt mit Namen, Adresse, Telefonnummer des Patienten und Hausarztes vorbereitet. Diese Angaben kommen auch auf den bekannten Marcumar-Ausweis, der von der Firma Hoffmann-La Roche oder der Firma Dade (Führerscheinformat) kostenlos bezogen werden kann. Ebenso ist ein kleiner Ausweis im Scheckkartenformat erhältlich, den der Patient immer bei sich tragen sollte, um im Falle eines Unfalls den behandelnden Notarzt bzw. die Rettungssanitäter auf die besondere Situation dieses Patienten hinzuweisen. Neuerdings existiert auch ein "Europäischer Antikoagulanzien-Pass", der für Reisende und auch Ausländer zu empfehlen ist. Hier sind in 11 europäischen Sprachen die wichtigsten Informationen für Patient und Arzt enthalten. Ebenso bekommt der Patient eine Tabelle mit Lebensmitteln, die einen hohen Gehalt an Vitamin K aufweisen (> 100 µg Vitamin K pro 100 g Lebensmittel).
Diese 5 Schriftstücke (Merkblatt, Marcumarausweis, blauer Europäischer Antikoagulanzien-Pass, scheckkartengroßer Ausweis, Vitamin K-Lebensmittel-Tabelle) erhält der Patient im Anschluß an die Beratung in einer Klarsichthülle DIN A6 ausgehändigt.
1.2 Beratung
1.2.1 Notwendigkeit der Therapie/Eigenschaft des verwendeten Antikoagulans
Ganz besonderen Wert sollte man darauf legen, dem Patienten die Notwendigkeit der Marcumartherapie klarzumachen und so die Compliance zu fördern. Dazu gehören Informationen über den Arzneistoff selbst (Gegenspieler von Vitamin K; verhindert Bildung eines Blutpfropfes etc.). Der Patient sollte über die vorgesehene Dauer der Antikoagulanzien-Behandlung informiert werden [1]. Anhand einer Checkliste kann man dann Punkt für Punkt die für den Patienten wichtigen und notwendigen Informationen vortragen und erläutern. Auf diese Weise wird erreicht, daß jeder Patient die gleichen Informationen - sinnvoll strukturiert -erhält. Damit ist ein qualitativ hochwertiger Service sichergestellt. Dazu gehört:
— Name des Arzneimittels, das der Patient bekommen soll.
— Vorzeigen der Packung bei einer Neueinstellung.
—Vorgesehener Gebrauch und erwartete Wirkung.
—Applikationsart, Dosierung, Einnahmemodus.
—Spezielle Anweisung für die Anwendung.
—Vorsichtsmaßnahmen bei der Anwendung.
—Häufige unerwünschte Wirkungen, mit denen gerechnet werden muß,
inklusive ihrer Vermeidung und Maßnahmen, die getroffen werden müssen, wenn sie
auftreten. Dazu gehören Blutungen in den Urin und dadurch Verfärbung; roter
oder schwarzer Stuhl, Nasenblutungen, Zahnfleischblutungen, verlängerte
Blutungen nach Schnittverletzungen. Diese Informationen dienen nicht der
Panikmache, sondern müssen vom Patienten gewußt werden [2]. Dadurch wird dem
Patienten die Angst genommen, falls es in der Praxis zu solchen Blutungen kommen
sollte (siehe Tab. 7) und er daher adäquat reagieren kann.
—Methoden zur Selbstkontrolle der Arzneimitteltherapie.
—Ordnungsgemäße Aufbewahrung.
—Erläuterung von möglichen Arzneimittel- oder
Arzneimittel-Nahrungsmittelinteraktionen und anderen therapeutischen Kontraindikationen.
(Hier sollte unbedingt beim Patienten nachgefragt werden, auch indem
man bestimmte Präparate namentlich nennt, ob er weitere Arzneimittel einnimmt, die
er dem Krankenhaus-Arzt nicht genannt hat. Unsere bisherige Erfahrung zeigt, daß
in vielen Fällen weitere Präparate zu berücksichtigen sind (Hormone,
Schmerzmittel etc.)
—Vorgehen bei Vergessen einer Einnahme.
—Spezielle Informationen zu dem Arzneimittel, der Erkrankung und deren
Behandlung [82].
Gegegebenfalls wird einer Patientin auch ein zusätzliches Merkblatt ausgehändigt, in dem erläutert wird, daß eine Schwangerschaft auszuschließen ist. Erfährt eine Patientin während einer Marcumartherapie, daß sie schwanger ist, sollte sie über die Risiken des Fetus und ihre eigenen Risiken durch eventuelles Absetzen informiert werden. Es muß dann auf Heparin umgestellt werden. (Siehe auch Nebenwirkungen).
1.2.2 Allgemeine Lebensführung
Im Gegensatz zu einer weitverbreiteten Meinung gelten für Patienten unter
Cumarin-Behandlung keine besonderen Diätvorschriften, vorausgesetzt, daß eine
gleichbleibende Ernährungsweise beibehalten wird.
Es kann deutlich gemacht werden, daß man beispielsweise durchaus auch
Lebensmittel mit hohem Gehalt an Vit. K wie Spinat, Rosenkohl, Blumenkohl etc.
essen darf. Zu vermeiden ist lediglich die Zufuhr exzessiver Mengen dieser
Gemüse. Entscheidend ist die möglichst gleichbleibende Ernährungsweise des Patienten.
In den Grundzügen also gleichbleibende normale Vollkost oder indizierte
Diätkost ohne extreme Bevorzugung oder Ausschaltung bestimmter Gerichte. Die
Fettzufuhr sollte auf die Höhe der Empfehlungen für die Ernährung des gesunden
Erwachsenen (<30% der Energiezufuhr) begrenzt werden. Für eine Bevorzugung
fettarmer Lebensmittel, z.B. magere Wurst und Fleisch, magerer
Käsesorten und eine fettarme Zubereitung plädiert auch die DGE.
Auch der Genuß von Alkohol kann wegen seiner Wirkung
auf die Leber das Gerinnungssystem beeinflussen. Größere
Mengen Alkohol sind daher zu vermeiden. Übliche kleinere Mengen
Alkohol können (z.B. zu Mahlzeiten) ohne Gefahr
konsumiert werden. Waldmeisterbowle ist vorsichtshalber zu
vermeiden, ebenso hochdosierte medikamentöse Vitamin E-Zufuhr,
das dasselbe Abbauprinzip wie Vitamin K aufweist [80].
Die Erfahrung mit unseren bisherigen Patienten zeigt,
daß teilweise abenteuerliche Vorstellungen zu der
notwendigen Ernährungsweise kolportiert werden, mit denen sich die
Patienten selbst unnötige Zwänge auferlegen.
Gewichtsreduzierende Diäten (oft reich an grünem
Gemüse) oder Nahrungsergänzungen mit einem hohen Gehalt an
Vitamin K können die Wirkung der Antikoagulanzien nachhaltig
beeinflussen [32] und sind daher zu vermeiden.
Überhaupt scheint die Zufuhr von Vitamin K über die
Nahrung die entscheidende Quelle zu sein; die Produktion durch
Darmbakterien ist weniger relevant [38].
Bei den Angaben über den Vitamin K-Gehalt in Lebensmitteln bestehen teilweise große Unterschiede. Daher hat es keinen Sinn, den Vitamin K-Gehalt eines Speiseplanes zu berechnen [78]. Geringe Portionen können gerade auch von Vitamin K-reichen Lebensmitteln durchaus konsumiert werden [79].
Tabelle 15 nennt die Lebensmittel mit einem hohen Gehalt (> 100 µg pro 100 g Lebensmittel) an Vitamin K.
Tabelle 16 führt Lebensmittel mit einem mittleren Gehalt (10 bis 100 µg pro 100 g Lebensmittel) auf. Tabelle 17 schließlich nennt Lebensmittel mit einem geringen Gehalt (< 10 µg pro 100 g Lebensmittel) an Vitamin K.
Fraglos macht sich die Ernährungsumstellung bei der Einstellung der Antikoagulanzien-Therapie von der Krankenhauskost auf die häusliche Ernährungsweise bemerkbar [81]. Insofern sollte der die Bestimmung des Quick-Wertes durchführende Hausarzt zunächst für einige Tage auf die Konstanz der Thromboplastinzeit sein Augenmerk legen [81].
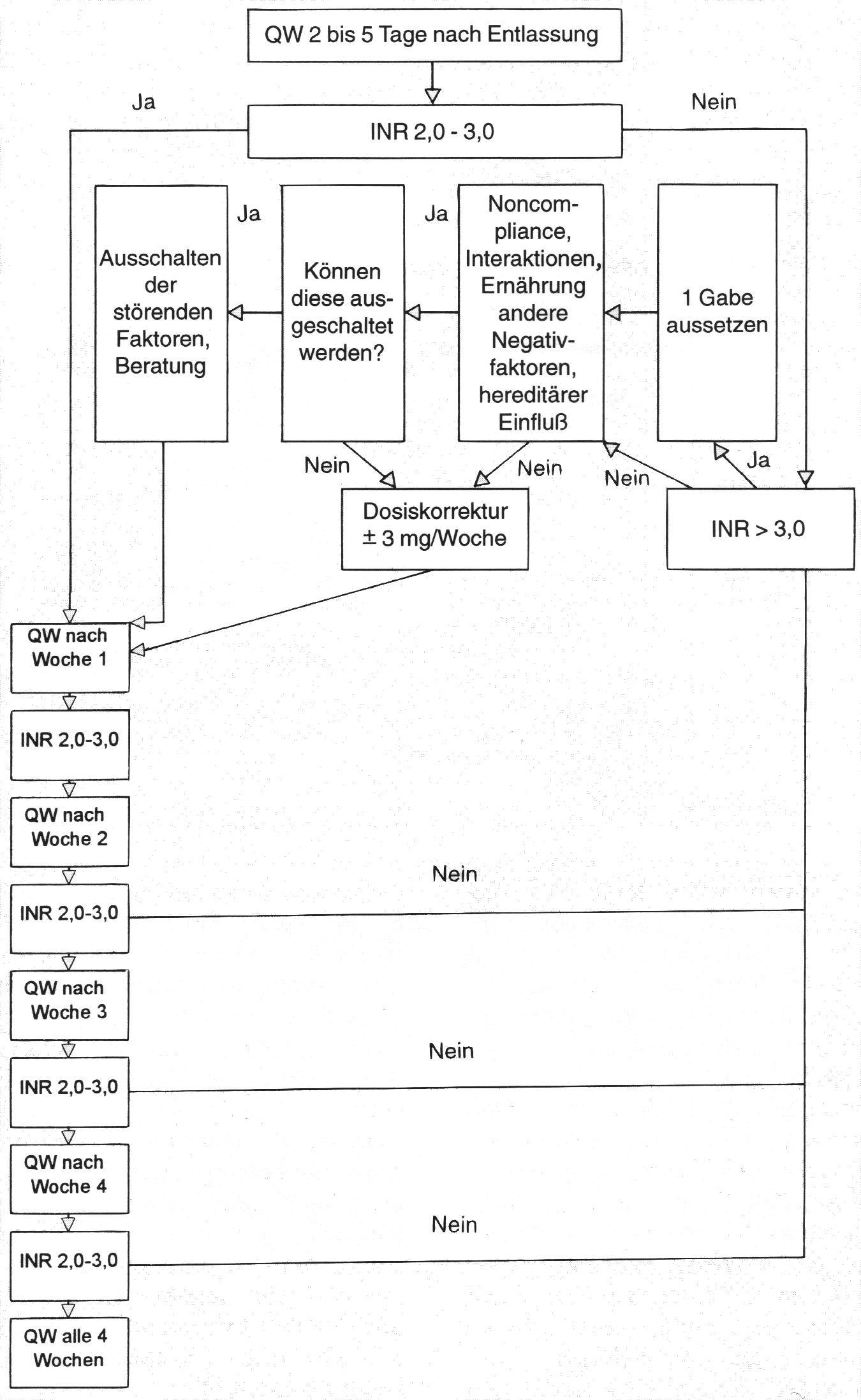
Möglicherweise sind Reisen in Länder, in denen der Organismus stark belastet wird (tropische und subtropische Länder) nicht angeraten. Es sollte zumindest auf die Zeitverschiebung und auch auf die veränderte Einnahme von Nahrungsmitteln bzw. evtl. auftretende Diarrhöen hingewiesen werden.
Selbst Marcumarpatienten, die schon jahrelang auf das Präparat eingestellt sind, können, wie die Praxis gezeigt hat, noch von unserer Beratung profitieren. Daher beschränken wir unseren Service nicht nur auf Patienten, die stationär zum ersten Mal auf Marcumar® eingestellt werden.[82]
1.2.3 Umgang mit Phenprocoumon und Warfarin
In diesem dritten Punkt wird auf die pünktliche Befolgung
der ärztlichen Dosierungsrichtlinien verwiesen. Die Tabletten
sollen nicht über den Tag verteilt, sondern auf einmal
eingenommen werden [48]. Die Tabletten sind unzerkaut mit Flüssigkeit
zu schlucken und nicht erst vorher aufzulösen. Wir empfehlen,
die Tabletten abends einzunehmen, um ein Vergessen
auszuschließen (Ritual des Zubettgehens), und dies in einem
kleinen Kalender festzuhalten.
Dies ist eine weitere organisatorische Maßnahme gegen das Vergessen bzw.
eine Dokumentation gegenüber dem Arzt für erfolgte Einnahmen.
Außerdem kann durch die Quick-Wert-Bestimmung am nächsten Morgen
gegebenenfalls korrigierend therapiert werden [89].
Sollte der Patient eine Dosis vergessen, kann er die Einnahme, falls es ihm
innerhalb der nächsten 12 Stunden einfällt, nachholen, dagegen sollte nach 12
Stunden die Einnahme entfallen. Auf keinen Fall darf er eine Extradosis einnehmen.
Der Patient sollte dafür Sorge tragen, daß er immer ausreichend mit
dem Antikoagulans versorgt ist, d.h., daß er sich rechtzeitig das Präparat vom
Arzt rezeptieren lassen und in der Apotheke einlösen muß.
Ganz eindringlich wird vor der eigenmächtigen Einnahme und dem Absetzen
von Arzneimitteln (z.B. Aspirin®) und Nahrungsergänzungen gewarnt. Da die
Einsichtnahme der Patientenakte zeigt, ob der Patient Arzneimittel nach seiner
Entlassung einnehmen muß, kann der beratende Apotheker nochmals besonderen
Nachdruck auf die korrekte Einnahme legen bzw. den Patienten warnen, eigenmächtig
bestimmte Arzneimittel abzusetzen oder einzunehmen.
Beachtet werden muß dabei [31], daß gerade Arzneimittel, die die
Thrombozytenfunktion beeinflussen, die Prothrombinzeit nicht beeinflussen.
Wenn der Patient auf Antikoagulanzien eingestellt wird, sollte der Arzt
wissen, welche anderen Arzneimittel ein Patient nimmt. Veränderungen sollten auf
ein Minimum eingeschränkt werden. Ist eine Arzneimittel-Gabe oder das
Absetzen eines Arzneimittels unumgänglich, sollte eine engmaschige Kontrolle des
Quick-Wertes für einige Wochen durchgeführt werden. Auch Arzneimittel, für die
bislang keine Interaktion mit Antikoagulanzien beschrieben sind, sollten mit
Vorsicht angewendet und der Quick-Wert sollte zu Beginn und zum Ende der Gabe
öfter bestimmt werden [43].
Während der Behandlung mit oralen Antikoagulanzien sind intramuskuäre Injektionen wegen Einblutungsgefahr in die Muskulatur zu vermeiden[1]. Intravenöse und subkutane Injektionen können vorgenommen werden.
1.2.4 Hausarzt
Den Antikoagulanzien-Ausweis sollte man stets bei sich tragen, um einem
notfallmäßig zugezogenen Arzt die notwendigen Informationen zu vermitteln.
Der Patient wird gebeten, den Marcumarausweis allen Ärzten, Zahnärzten und
auch dem Apotheker vorzuzeigen bzw. auf seine Antikoagulanzientherapie
aufmerksam zu machen. Er sollte mit seinem Hausarzt absprechen, wo die
Gerinnungskontrollen durchgeführt werden und wer die Dosierung bestimmt. Auch auf
die Notwendigkeit der regelmäßigen Kontrollen und das Einhalten der
Untersuchungstermine ist der Patient hinzuweisen.
Dem Patienten wird erklärt, daß die Überwachung des Gerinnungssystems
im Labor mit Hilfe des Quick-Wertes erfolgt. Das Ergebnis zeigt dem Arzt, ob
eine Dosisanpassung erforderlich ist. Das Resultat der Laborbestimmungen
(Quick-Wert) kann auch als INR-Wert angegeben werden (zukünftig zu favorisieren)
und erlaubt eine Vergleichbarkeit der Laborwerte auch im Urlaub oder bei
einem Wechsel des Arztes nach einem Umzug.
Es muß dem Patienten erklärt werden, daß bei ihm Operationen und
zahnärztliche Eingriffe nur nach entsprechender Vorbereitung erfolgen dürfen [1].
Nach Aushändigen des kleinen Pakets mit dem Merkblatt, dem Antikoagulanzienausweis, dem Europäischen Antikoagulanzien-Pass, der Lebensmittelliste und der Notfallkarte, ist die Beratung abgeschlossen.
Der Patient bekommt ferner einen Fragebogen ausgehändigt, in dem er einige Fragen zu unserem Service (Verständlichkeit, Ausführlichkeit, Relevanz der Informationen für ihn als Patienten etc.) beantworten kann und auch eigene Vorschläge zur Verbesserung anführen kann. Auf diese Weise läßt sich die Qualität des Service', unmittelbar von der Zentralperson Patient beurteilt, verbessern.
1.2.5 Datenerfassung zu Pharmakovigilanz, Compliance, sonstiger relevanter Ereignisse während der Therapie
Es ist beabsichtigt, nach einem gewissen Zeitraum (evtl. 3-4 Jahre), die ambulant betreuenden Ärzte anzuschreiben, mit der Bitte um Übermittlung der Daten zur Pharmakovigilanz, der Compliance des Patienten bzw. sonstiger relevanter Ereignisse während der Therapie. Anhand dieser Angaben soll dann eine Qualitäts-Statistik erstellt werden, die belegen müßte, daß sich ein solcher Konsiliardienst des Krankenhausapothekers für den Patienten im Sinne der Arzneimittelsicherheit auszahlt.
[1] Oehler G, Kemkes-Matthes B.
Blutgerinnung und Thrombose.
Thrombose-Schriftenreihe 1991
Sandoz AG, Nürnberg.
[2] Jaenecke J.
Antikoagulantien- und Fibrinolysetherapie
Stuttgart, New York: Georg Thieme Verlag,
4. Auflage 1991.
[3] Akkerman JWN, Nieuwenhuis HK, Sixma JJ.
Thrombose und Arteriosklerose-Therapie.
Dr. Karl Thomae GmbH.
[4] Marx R, Thies HA, Tilsner V, Hrsg..
Aktuelle Antikoagulation in Klinik und Praxis
Editiones Roche 1982.
[5] Tilsner V, Heimburger N, Becker U, Göpfert H, Kolde H-J.
Gerinnungsdiagnostik für Diagnose und Therapie
Behringwerke AG, 1986.
[6] Marx R, Thies HA, Hrsg.
Lunge, Blutgerinnung und Hämostase
Editiones Roche 1981.
[7] Akkerman JNN, Bouma BN, Sixma JJ.
Hämostase
Dr. Karl Thomae GmbH, 1982.
[8] Abdulla W, Frey R, Withke G.
Bluttransfusion und Blutgerinnung
Stuttgart, New York: Gustav Fischer Verlag, 1979.
[9] Meyer-Bertenrath JG.
Blutgerinnung und Fubrinolyse
5. Auflage 1980
Deutscher Ärzteverlag.
[10] Roka L, Spanuth E.
Neue Aspekte in der Gerinnungsdiagnostik
Schattauer Verlag, 1984.
[11] ABDA-Datenbank V2.97.
[12] Gelman Cr & Rumack BH, editors.
Drugdex Information System.
Micromedex Inc., Englewood, Colorado (Vd.84 1995).
[13] Kussmann J, Weinel R, Rothmund M.
Hämostasestörung und Operationsfähigkeit.
In: Blutgerinnung und Intensivmedizin
EditionesRoche 1991.
[14] Ernst B, Steiner M, Burstein C, Anders O, Northemann W, Ishii H.
Der Thrombinrezeptor Thrombomodulin - Fakten und Hoffnungen
In: Endothele und Blutgerinnung
Editiones Roche 1992.
[15] Schwarz HPC, Watzke H.
Protein S - der Protein C-Cofaktor.
In: Physiologie und Pathophysiologie des Vitmains K
Editiones Roche 1986.
[16] Thorp JA, Gaston L, Caspers DR, Pal ML.
Current concepts and controversies in the use ofvitamin k.
Drugs 1995;49:376-387.
[17] Howard PA.
Monitoring warfarin therapy with the international normalized ratio.
The Annals of Pharmcotherapy 1994;28:242-244.
[18] Force RW, Roush MK, Bussey HI.
Warfarin and the international normalized ratio.
The Annals of Pharmacotherapy 1992;26:430-31.
[19] Poller L.
A sample nomogram for the derivation of international normalized ratios for the standardisation of
prothrombin times.
Thromb. Haemost. 1988;60:18-20.
[20] Coulshed DS, Fitzpatrick MA, Lee CP.
Drug treatment associated with heart valve replacement.
Drugs 1995;49:897-911.
[21] Saour J, Gallus A.
Warfarin: is it time to reduce target ranges again?
Aust.N.Z.J.Med. 1993;23:692-696.
[22] Antunes MJ.
Isolated replacement of a prothesis or a bioprothesis in the aortic valveposition.
Am J Cardiol. 1987;59:350-352.
[23] Fitzpatrick MA, McCone F.
An audit of anticoagulation and endocarditis prophylaxeis after heart valve surgery.
N Z Med. J 1991;104:85-88.
[24] Tinker JH, Tarkan S.
Discontinuing anticoagulant therapy in surgical patients with cardiac valve prosthesis: observations in
180 operations.
JAMA 1978;239:738-739.
[25] Turpie AG, Gent M, Laupacis A et al.
A comparison of aspirin with placebo in patients treated with warfarin after heartvalve replacement.
N Engl.J.Med. 1993;329:524-529.
[26] SPAF Investigators
Stroke prevention in atrial fibrillation study. Final results
Circulation 1991;84:527-539.
[27] Coplen SE, Antman EM, Berlin JA, Hewitt P, Chalmers TL
Efficacy and safety of quinidine therapy for maintenance of sinus rhythm after cardioversion.
A meta-analysis of randomized control trials.
Circulation 1990;82:1106-1116 .
[28] BAATAF Investigators
The effect of low-dose warfarin on the risk of stroke in patients with nonrheumatic atrial fibrillation
The Boston Area Anticoagulation Trial for Atrial Fibrillation Investigators
N Engl. J. Med. 1990;323:1505-1511.
[29] Chesebro JH, Fuster V, Halperin JL.
Atrial fibrillation - Risk marker for stroke.
N Engl J Med 1990;323:1556-1558.
[30] EAFT Study Group
Secondry prevention in non-rheumatic atrial fibnrillation after transient ischaemic attack or minor
stroke.
The lancet 1993;342:1255-1262 .
[31] Deykin D.
Warfarin therapy (Second of two parts).
N Engl J Med 1970;283: 801-803 .
[32] Hirsh J.
Oral anticoagulant drugs.
N Engl J Med 1991;324:1865-1875.
[33] Turpie AGG, Gunstensen J, Hirsh J, Nelson H, Gent M.
Randomized comparison of two intensities of oral antcoagulant therapy after tissue heart valve
replacement.
The lancet 1988;1:1242-1245
[34] Saour JN, Sieck JO, Mamo LAR, Garlus AS.
Trial of different intensities of anticoagulation in patients with prosthetic heart valves.
N Engl J Med 1990;322: 428-432.
[35] White RH, McCurdy SA, von Marensdorff H, Woodruff JR, Leftg L.
Home prothrombin time monitoring after the initiation of warfarin therapy: an randomized prospective
study.
Ann. Intern. Med. 1989;11: 7
[36] Laupacis A. et al.
Risc factors for stroke and efficacy of antithrombptic therapy in atrial fibrillation. Analysis of pooled
data from five randomized controlled trials.
Arch.Intern.Med. 1994;154;1449-1457.
[37] Wolf PA, Dawber TR, Thomas HE, Kannel WB.
Epidemiologic assessment of chronic atrial fibrillation and risk of stroke: The Framingham Study.
Neurology 1978;28:973-977 .
[38] Lipsky JJ.
Nutritional sources of vitamin K.
Mayo Clin Proc 1994;69:462-466 .
[39] Shearer MJ.
Vitamin K and vitamin-dependent proteins.
British Journal of Haematology 1990;75:156-162 .
[40] Deykins D.
Warfarin Therapy (first of two parts).
N Engl J Med 1970;283:691-694 .
[41] Koch-weser J, Sellers EM.
Drug interactions with coumarin anticoagulants (first of two parts).
N Engl J Med 1971;285:487-498.
[42] Kirchhof B.
Gerinnungsstörungen.
Stuttgart: WVG mbH 1987, S.97
[43] Koch-Weser J, Sellers EM.
Drug interactions with coumarin anticoagulant (second of two parts).
N Engl J Med 1971;285: 547-558 .
[44] Saour JN, Sieck JO, Mamo LAR, Gallus AS.
Trial of different intensities of anticoagulatopn in patients with prosthetic heart valves.
N Engl J Med 1990;322:428-432.
[45] Lipsky JJ.
N-Methyl-thio-tetrazole inhibition of the gamma carboxylation of glutamic acid: possible mechanism
for antibiotic-associated hypoprothrombinaemia.
The Lancet 1983; 2:192-193.
[46] Mitchell MC, Mallat A, Lipsky JJ.
Cephalosporin-induced alteration in hepatic glutathione redox state.
J. Clin. Invest. 1990;86:1589-1594.
[47] Fennerty A, Dolben J, Thomas P, Bakhouse G, Bentley DP, Campbeel IA.
Flexible induction dose regimen for warfarin and prediction of maintenance dose.
Br Med J 1984;288:1268-1270.
[48] Hiemeyer V.
Die Antikoagulation mit Cumarinen beim ambulanten Patienten.
Moderne Medizin 1980;8:832-839.
[49] Wessler S, Gitel SN.
Warfarin - From bedside to bench.
N Engl J Med 1984;311:645-652.
[50] Hiller E, Riess H.
Klinische Bedeutung der Gerinnungsinhibitioren Antithrombin III und Protein C.
Therapiewoche 1985;35:1533-1541.
[51] Beeser H.
Überwachung der Behandlung mit Cumarinderivaten.
In: Thrombophilie und Antikoagulation.
Editiones Roche 1994.
[52] Bruhn HD, Zurborn KH.
Kontrolle des individuellen antikoagulatorischen Effekts einer behandlung mit oralen Cumarin-
derivaten in niedriger Intensität durch Messung des Prothrombinfragmentes F1+2.
In: Thrombophilie und Antikoagulation.
Editiones Roche 1994.
[53] Matthias FR.
Blutgerinnungsstörungen: Häorrhagische Diathese und thromboembolische Erkrnaungen.
Berlin,Heidelberg,New York,Tokio:Springer Verlag , 1985.
[54] Barthes M, Poliwoda H.
Gerinnungsanalysen.
Suttgart,New York: Thieme Verlag 1993, 4. Auflage.
[55] Kemkes-Matthes B.
Orale Antikoagulantien.
In: Thrombolyse und Antikoagulation in der Kardiologie.
Hach-Wunderle V, Neuhaus KL, Hrsg.
Springer Verlag, 1994.
[56] Terres W, Meinertz T.
Langzeittherapie mit Antikoagulantien und Thriombozytenaggregationshemmern bei koronarer
Herz- krankheit.
In: Thrombolyse und Antikoagulation in der Kardiologie.
Hach-Wunderle V, Neuhaus KL, Hrsg.
Springer Verlag, 1994.
[57] Zimmermann R.
Gerinnungshemmende Behandlung des chronischen Vorhofflimmerns.
In: Thrombolyse und Antikoagulation in der Kardiologie.
Hach-Wunderle V, Neuhaus KL, Hrsg.
Springer Verlag, 1994.
[58] Horstkotte D, Schultheiss HP.
Langzeitantikoagulation bei Herzklappenmfehlern.
In: Thrombolyse und Antikoagulation in der Kardiologie.
Hach-Wunderle V, Neuhaus KL, Hrsg.
Springer Verlag, 1994.
[59] Bernardo A, Schüpphaus S, Taborski U, Wittstamm FJ.
Die Selbstkontrolle der oralen Antikoagulation.
Dt Ärztebl 1995;92:442-444.
[60] Schüler A, Gulba D, Sosada M, Ringe B, Pichlmayr R, Manns M.
Prevention of postoperative thromboembolic complications in a patient with budd-chiari syndrome, and
acquired protein C deficiency by short-term administration of protein c concentrates.
Fibrinolysis 1995;9:129-132, Suppl.1.
[61] Van de Loo JCW, Stenziger W.
Antithrombotic prophylaxis in arterial and venous vessel diseases.
Fibrinolysis 1995;9:58-65, Suppl.1.
[62] Piesche L., Boelke T.
Comparative clinical trial investigating possible interactions of torasemide or furosemide with
phenprocoumon in patients with congestive heart failure.
In: Puschelt JB, editor. Diuretics IV; Chemistry, Pharmacology and Clinical Applications (Fourth
International Congress on diuretics).
Amsterdam :Elsevier Publ.,1993.
[63] Haustein KO, Huller G.
Pharmacokinetics of phenprocoumon.
Int J Clin Pharmacol Ther 1994;32:192-197.
[64] Harder S, Brei R, Caspary S, Merz PG.
Lack of pharmacokinetic interaction between carvedilol and digitoxin or phenprocoumon.
Euro. J. of Clinical Pharmcology 1993;44:583-586.
[65] Freude S, Pabinger-Fasching J, Kozel-Lackmann D, Braun F, Pollack A.
Warfarin-Embryopathie bei mütterlicher Coumarin-Therapie wegen Protein-S-Mangels.
Pädiatrie und Pädologie 1991;26:239-241.
[66] Zimmer R, Gieschke R, Fischbach R, Gasic S.
Interaction studies with moclobemide.
Acta Psychiatrica Scandinavica 1990;360:84-86.
[67] Moenig H, Bäse C, Heidemann HT, Ohnjaus EE, Schulte HM.
Effect of oral contraceptive streoids on the pharmacokinetics of phenprocoumon.
Br J of Clinical Pharmacology 1990;30:115-118.
[68] Hiller E.
Antikoagulanzien bei Risikopatienten.
Arzneimitteltherapie 1991;9:80-83 .
[69] Kohl P, Niedermaier J, Hiller E.
Therapie mit Cumarinderivaten.
Arzneimitteltherapie 1992;10:107-110 .
[70] Dalen JE, Hirsh J.
Consensus Paper.
Arch. Int. Med. 1986;146:463.
[71] Ezekowitz MD, Bridgers SL, James KE et al.
Warfarin in the prevention of stroke associated with nonrheumatic atrial fibrillation
(SPINAF Studie).
N Engl J Med 1992;327:1406-1412 .
[72] Harenberg J, Staiger C, deVries JX, Walter E, Weber E et al.
Cimetidine does not increase the anticoagulant effect of phenprocoumon.
Br J Clin Pharmacol 1982;14:292-293 .
[73] van der Meer FJM, Rosendaal FR, Vandenbroucke JP, Briet E.
Bleeding Complications in Oral Anticoagulant Therapy.
Arch Intern Med 1993;153:1557-1562.
[74] Wiechmann HW.
Wechselwirkungen mit Marcumar?
Med Mo Pharm 1987;10:326 .
[75] Anonymus.
Antikoagulanzien beim Antiphospholipid-Antikörper-Syndrom (AAS).
Der Arzneimittelbrief 1995;29:56 .
[76] Wiebke D.
Phenprocoumon.
Dtsch Apoth Ztg 1988;128:2310-2312.
[77] Standardinfromation für Krankenhausapotheker.
Marcumar.
Hoffmann-La Roche AG, Stand 9/94.
[78] Heepe F.
Diätetische Indikationen.
Berlin, Heidelberg:Springer Verlag,1994, 2. Auflage
[79] Ernährungsratgeber DGE.
Deutsche Gesellschaft für Ernärhung (DGE).
Auflage 1989.
[80] Richtige Ernährung bei Herz-Kreislauferkrankungen und Bluthochdruck.
Deutsche Gesellschaft für Ernährung.
Auflage 1988.
[81] Biesalski HK, Fürst V, Kasper H, Kluthe R, Pölert W, Puchstein C, Stähelin HB, Hrsg.
Ernährungsmedizin.
Stuttgart, New York:Georg Thieme Verlag, 1995.
[82] Bodem SH.
Compliance in der Arzneitherapie: Herausforderung für den Apotheker.
Pharm Z 1995;140:1655-1664.
[83] Hansten PD.
Arzneimittel-Interaktionen.
Stuttgart:Hippokrates-Verlag, 1981, 2. Auflage.
[84] Griffin JP, D'Arcy PF.
Arzneimittelinteraktionen
München, Wien:R.Oldenbourg Verlag, 1981.
[85] Loza JP, Gurewich V, Johnstone M, Pannell R.
Platelet-bound prekallikrein promotes pro-urikinase-induced clot lysis: a mechanism for targeting the
factor XII dependent intrinsic pathway of fibrinolysis.
Thromb-Haemost. 1994;72:347-351.
[86] News from the 15th European Society of Cardiology Inpharma 1993; 906:6 Meeting Report; published
25/9/93
[87] den Boer W, Loeliger EA.
Phenprocoumon-induced jaundice.
The Lancet 1976;i:912.
[88] Slagboom G, Loeliger EA.
Coumarin-associated hepatitis:report of two cases.
Arch Intern Med 1980;140:1028-1029 .
[89] Goodman and Gilman's.
The Pharmaceutical Basis of Therapeutics.
Mc Gaw-Hill, 8. Auflage.
Pergamon-Press 1990.
[90] Di Piro JT, Talbert RL, Hayes PE, Yee GC, Posey LM.
Pharmacotherapy-A Pathophysiologic Approach.
Elsevier Science Publishing Co., 1989.
[91] Kuemmerle HP, Hitzenberger G, Spitzy KH, Hrsg.
Klinische Pharmakologie.
Ecomed Verlagsgesellschaft, 1984, 4. Auflage.
[92] Souci SW, Fachmann W, Kraut H.
Die Zusammensetzung der Lebensmittel.
Nährwerttabellen.
Stuttgart:Wissenschaftliche Verlagsgesellschaft mbH, 1995/96 , 5. Auflage.
[93] Kluthe Bertil.
Prodi expert V4.3.
Stuttgart:Wissenschaftliche Verlagsgesellschaft mbH,, 1995.
[94] Kienast J.
Antikoagulanzientherapie der Lungenembolie.
Krankenhaus Arzt 1993;66:16-20 .
[95] Bechtold H, Trenk D, Meinertz T, Rowland M, Jähnchen E.
Cyclic interconversion of vitamin k1 and vitamin k1 2,3-epoxide in man.
Br J Clin Pharmacol 1983;16:683-689 .
[96] Jeong E.
Using the international normalized ratios when monitoring protimes.
Hospital Pharmacy 1993;28:1076-1078.
[97] Hull R, Hirsh J, Jay R, Carter C, England C et al.
Different intensities of oral anticoagulant therapy in the treatment of proximal-vein thrombosis.
N Engl J Med 1982;307:1676-1681.
[98] Carter BL.
Therapy of acute thromboembolism with heparin and warfarin.
Clin Pharm 1991;10:503-518 .
[99] Lutomski DM, Djuric PE, Draeger RW.
Warfarin therapy: effect of heparin on prothrombin times.
Arch Intern Med 1987;147:432-433 .
[100] Sawyer WT, Raasch RH.
Effect of heparin on prothrombin time.
Clin Pharm 1984;3:192-194 .
[101] Sawyer WT.
Predictability of warfarin dose requirements: theoretical considerations.
J Pharm Sci 1979;68:432-434.
[102] Toon S, Heimark LD, Trager WF, O'-Reilly RA.
Metabolic fate of phenprocoumon in humans.
J Pharm Sci 1985;74:1037-1040 .
[103] Kitteringham NR, Bustgens L, Brundert E et al.
The effect of liver cirrhosis on the pharmacokinetics of phenprocoumon.
Eur J Clin Pharmacol 1984;26:65-70 .
[104] Kitteringham NR, Mineshita S, Ohnhaus EE.
The effect of wheat bran on the pharmacokinetics of phenprocoumon in normal volunteers.
Klin. Wochenschr. 1985;63:537-539 .
[105] Facts and Comparisons- Drug Information, 1994.
[106] Levine MH, Raskob G, Hirsh J.
Risk of hemorrage associated with long term anticoagulant therapy.
Drugs 1985;30: 444-460.
[107] Lawson DH, Lowe GDO.
Drug therapy reviews: clinical use of anticoagulant drugs.
Am J Hosp Pharm 1977;34:1225-1234.
[108] Kruis-de Vries MH, Stricker BHC, Coenraads PJ et al.
Maculopapular rash due to coumarin derivatives.
Dermatologica 1989;178: 109-111.
[109] McEvoy GK et al. ,editors.
Coagulants and Anticoagulants.
AHFS Drug Information 1995.
American Society of Health-System Pharmacists.
[110] arznei-telegramm 8/94.
[111] Bundesverband der Pharmazeutischen Industrie e.V., Hrsg.
Rote Liste 1995.
Aulendorf:Editio Cantor , 1995.
[112] Briggs GG, Freeman RK, Yaffe SJ.
Drugs in Pregnancy and Lactation: A Reference Guide to Fetal and neonatal Risk.
Baltimore:Williams & Wilkins, 1986, 2. Auflage.
[113] Young LY, Koda-Kimble MA, editors.
Applied therapeutics-The Clinical Use of Drugs.
Applied Therapeutics Inc, 1991, 4. Auflage.
[114] Ohler W.
Antikoagulantien- und Fibrinolysetherapie.
In: Weihrauch TR, Hrsg.
Wolff/Weihrauch: Internistische Therapie 1994/1995
Urban & Schwarzenberg, 1994, 10. Auflage.
[115] O'Mara K, Mavichak V.
Trauma and oral anticoagulants.
Am Emerg Med 1983;12: 700-703 .
[116] Umlas J, Harken HE.
Warfarin-induced alopecia.
Cutis 1988;42: 63-64.
[117] Arzneimittel-Kursbuch.
Transparenz-Telegramm 1992/93.
Berlin:A.V.I. Arzneimittel-Verlags GmbH, 1992.
[118] Wissenschaftliche Tabellen Geigy.
Ciba-Geigy, Basel, 1979, 8. Auflage.
[119] Schlick E.
Blutgerinnung - pharmakotherapeutische Beeinflussung.
Med. Mo. Pharm. 1982;5:1-10 .
[120] Rosiello RA, Chan CK, Tenceza F, Matthay RA.
Timing of oral anticoagulation therapy in the treatment of angiographical proven acute pulmonary
embolism.
Arch Intern Med 1987;1471469-1473 .
[121] Hylek EM, Singer DE.
Risk factors for intracranial hemorrage in outpatients taking warfarin.
Ann Intern Med 1994;120:897-902.
[122] Van Damme-Lombaerts R, Proesmans W, Van-Damme B, Eeckels R, Vermylen J et al.
Heparin plus dipyridamole in childhood hemolytic-uremic syndrome: prospective, randomized study.
J Pediatr 1988;113:913-918.
[123] Schwabe U, Paffrath D, Hrsg.
Arzneiverordnungs-Report '95
Stuttgart, Jena:Gustav Fischer Verlag, 1995.
Tab.: 1a Therapeutische Bereiche zu ausgewählten Indikationen
| British Societyfor Haematology 1990 | ACCP/NHLDIConsensus1989 | Andere Empfehlungen | |
| Prophylaxe einer postoperativen Beinvenenthrombose (Allgemeinchirurgie) | 2,0-2,5 | 2,0-3,0 | 2,0-3,0[51] |
| Prophylaxe einer postoperativen Beinvenenthrombose Hüftchirurgie und Frakturen | 2,0-3,0 | 2,0-3,0 | 2,0-3,0[51] |
| Vorbeugung von venösen Thrombosen und bei Myokardinfarkt | 2,0-3,0 | 2,0-3,0 | 2,0-3,0[51] |
| Zustand nach tiefen Bein-Beckenvenenthrombosen | 2,0-3,0 | 2,0-3,0 | 2,0-4,0[51] 2,0-3,0 [91] |
| Zustand nach Lungenembolien | 2,0-3,0 | 2,0-3,0 | 2,0-4,0[51] 2,0-3,0 [91] |
| Ischämie | 2,0-3,0 | 2,0-3,0 | 2,0-4,0 [51] 2,0-3,0 [91] |
| Herzklappenersatz mit Bioprothesen | 2,0-3,0 | 2,0-3,0 | |
| Vorhofflimmern | 2,0-3,0 | 2,0-3,0 | |
| Erkrankung der Herzklappen | 2,0-3,0 | 2,0-3,0 | |
| Arterieller Bypass | 3,0-4,5 [51] | ||
| Rezidivierende Beinvenenthrombosen | 3,0-4,5 | 2,0-3,0 | 3,0-4,5 [51] |
| Rezidivierende Lungenembolie | 3,0-4,5 | 2,0-3,0 | 3,0-4,5 [51] |
| Arterielle Erkrankungen einschließlich Myokardinfarkt | 3,0-4,5 | 2,0-3,0 | 3,0-4,5 [51] |
| Herzklappenersatz mit mechanischen Prothesen | 3,0-4,5 | 3,0-4,5 | 3,0-4,5 [51] |
| Wiederholte systemische Embolien | 3,0-4,5 | 3,0-4,5 | |
| Angeborener Mangel an AT III, Protein C und S | 3,0-4,5 [91] |
| Zielwert | Bereich | |
| Prä- und perioperative primärvenöse Prophylaxe | 2,0 | 1,5-2,5 |
| Postoperative primäre venöse Prophylaxe | 3,0 | 2,5-3,5 |
| Sekundäre venöse Prophylaxe | 3,0 | 2,5-4,0 |
| Nach Klappenersatzoperation | 4,0 | 3,5-5,0 |
Tab.: 2 Plasmahalbwertszeiten für Vit. K-abhängige Gerinnungsfaktoren und Inhibitoren in vivo [15]
| Prothrombin (Faktor II) | 40-60 h |
| Prokonvertin (Faktor VII) | 5-6 h |
| Christmas-Factor (Faktor IX) | 28-40 h |
| Stuart-Prower-Factor (Faktor X) | 40-50 h |
| Protein C | 4-6 h |
| Protein S | 40 h |
Tab.: 3 Indikationen und Dauer einer Antikoagulanzientherapie (Modifiziert nach [114]) Teilweise sind auch andere Literaturstellen mit deren Empfehlungen angegeben, um zu zeigen, daß kein allgemeiner Konsens darüber herrscht.
| Indikationen | Dauer |
| Mitralklappenstenose und Vorhofflimmern | Unbegrenzt bzw. bis zum Verschwinden des Thrombus |
| Vorhofflimmern und abgelaufene Embolie | 24 Monate bis unbegrenzt (solange Thrombusnachweis) |
| Akuter Myokardinfarkt besonders nach Fibrinolysetherapie und/oder unkomplizierter Myokardinfarkt | 6 Monate ;1-3 Monate[49]; bis 1 Jahr [91] |
| Komplizierter Myokardinfarkt (Rhythmusstörung, Aneurysma mit Thrombus- behandlung, Embolie) | bis zum Abklingen des Thrombose-/Embolierisikos |
| Reinfarkt | Unbegrenzt bzw. Thrombozytenaggregation;unbegrenzt[49] |
| Herzklappenersatz (synth.) | unbegrenzt |
| Herzklappenersatz (Bioprothese) | 6 Monate; 3 Monate[1] |
| Periphere arterielle Durchblutungsstörung | unbegrenzt (umstritten) bzw. Thrombozytenaggregationshemmung (z.Z. erste Wahl) |
| Rekonstruktive Arterien-OP, bes. femoralpoplitealer Bypass | unbegrenzt bzw. Thrombozytenaggregationshemmung(z.Z. erste Wahl) |
| Lungenembolie | 6-9 Monate; 1-6 Monate;3-6 Monate[4];12-24Monate[55];3 Monate [6] 3-6 Monate[98];2-6 Monate[119];6-12Monate[61]+[1];3-6Monate[70] |
| Lungenembolierezidiv | 12-24 Monate bis unbegrenzt |
| Thrombose tiefer Bein-Beckenvenen | 6-12 Monate ;1-6Monate[119];6-12Monate[55] 3-6 Wochen [98];3-6Monate[49];3-6Monate[61]+[1]; 3-6 Monate[70] |
| Thromboserezidiv | Unbegrenzt;12Monate bis unbegrenzt[49] |
| AT III-Mangel | Unbegrenzt nach Thrombosen [70] |
| Protein C- und S-Mangel | Unbegrenzt nach Thrombosen [70] |
| Prophylaxe bei thrombose-gefährdeten Patienten im Rahmen von Operationen, Unfällen und Geburt | 1-3 Monate [119], (z.Z. meist LMWH) |
| Rheumatische Herzkrankheit mit Vorhofflimmern | unbegrenzt[49] |
| Hüftgelenks-OP | 3 Monate[49]; (z.Z. meist LMWH) |
| Transitorische ischämische Attacke | 1 bis mehrere Jahre [49]; (z.Z.meist ASS) |
Tab.: 4 Empfehlungen zur Vorbereitung auf operative Eingriffe bei Patienten, die mit Vitamin K-Antagonisten behandelt werden
| Eingriff | Vorbereitung | Quick-Wert |
| Zahnextraktion | 2-3 Tage Pause | ca. 30 % |
| Kleine Operation | 3-6 Tage Pause | ca. 40% |
| Größere Operation | 3-8 Tage Pause ggf. + 3-5 mg Vit.K | ca. 60% |
| Sofort notwendige Operation | FFP oder 1000-2000 E. PPSB+ 5-10 mg Konaktion | 30-60% |
| bei allen Maßnahmen in Abhängigkeit vom Thromboserisiko | 2 x 5000 E. Heparin/Tag oder LMWH s.cnach [114] und [1] |
Tab.: 5 Vergleich gebräuchlicher Cumarinderivate
| HWZ (h) | Wirkdauer (Tage) | Therapeutische Wirkung erreicht(Tage) |
|
| Acenocoumarol (Sintrom®) | 9(-20) | 1-3(-6) | (1-)2-3 |
| Ethylbiscoumacetat | 2-3 | 2-3 | 2 |
| Phenprocoumon (Marcumar®) | 150-160 | 4-7 (<14) | 2-4 |
| Warfarin (Coumadin®) | 50(36-42) | 3-5(-8) | 2-3 |
Tab.: 6 Nebenwirkungen blutungsbedingt [1, 2] Prozent aller Blutungskomplikationen
| Nieren und Harnwege | 40% |
| Nasen und Rachenraum | 18% |
| Gastrointestinaltrakt | 18% |
| Auge | 13% |
| ZNS | 3% [2] 2%[at11/94] |
| Mundbereich (Zahnfleisch) | 2% |
| Übrige(Nebenniereninsuffizienz durch Nebennierenblutung) | 6% |
| Gesamtrisiko bei optimaler Einstellung: | 3-5% |
Tab.: 7a Nebenwirkungen [1, 111]
blutungsbedingt
| Mikrohämaturie, |
| Zahnfleischblutungen, |
| Nasenblutung, |
| Hämatome nach Verletzungen, |
| Blutungen aus Gastrointestinaltrakt, |
| Lebensbedrohend im Bereich Rückenmark, Gehirn, Nebenniere, Herzbeutel, Pleurahöhle, Einblutung in Darmwand |
Tab.: 7b Nebenwirkungen [1, 111]
nicht blutungsbedingt
| Magen-Darm-Unverträglichkeiten
— Appetitlosigkeit — Übelkeit — Erbrechen — Diarrhö |
| Urtikaria |
| Dermatitis |
| Cumarinnekrose |
| Alopecia diffusa |
| Erhöhung Transaminasen (passager) |
| Störungen Knochenaufbau (Kallusbildung) |
| Agranulozytose/Eosinophilie/Leukopenie, Purpura |
| Schleimhautgeschwür |
| Leberparenchymschäden |
| Gelb-orangefärbung des alkalischen Urins |
Tab.: 8 Indikationen und Kontraindikationen zur Antikoagulanzienbehandlung bei Tumorpatienten [68]
| Indikationen |
| Erfolgreich therapierte Patienten wie bei Gesunden (d.h. ohne Resttumor) |
| Geringes Risiko von Tumorblutungen (z.B. Skelettmetastasen, Lymphom etc.) und Lebenserwartung von >6 Monaten). |
| Geringes Risiko von Tumorblutungen (z.B. Skelettmetastasen, Lymphom etc.) und Lebenserwartung von >6 Monaten). |
| Kontraindikationen |
| Gefahr einer Tumorblutung (z.B. Magen-Darm-Karzinom, Lungenkarzinom, Blasenkarzinom) |
| Ausgedehnte Lebermetastasierung |
| Thrombopenie |
| Kurze Lebenserwartung (<6 Monate) |
Tab.: 9 Kontraindikationen [1, 2, 55, 111]
| Absolute Kontraindikationen |
| Krankheiten mit erhöhter Blutungsbereitschaft
— Hämorrhagische Diathese, — Leberparenchymerkrankungen (je nach Ausprägung), — Niereninsuffizienz, — Schwere Thrombozytopenie |
| Erkrankungen, bei denen der Verdacht auf eine Läsion des Gefäßsystems besteht
— Magen-Darm-Ulcera, — Hypertonie (>105 mmg HG diastolisch; Fundus hypertonicus Grad >II), — Frischer Apoplex — Traumata nach chirurgischen Eingriffen am ZNS, — Retinopathien mit Blutungsrisiko, — Hirnarterienaneurysmen, — Floride Endokarditis — Frische Operationen |
| Kavernöse Lungentuberkulose |
| Schwangerschaft |
| Relative Kontraindikationen |
| — Anfallsleiden
— Chronischer Alkoholismus — Nephrolithiasis — Mangelnde Compliance |
Tab.: 10 Schwangerschaftsnebenwirkungen [48]
| 1. Trimenon (Risiko 15-25%) |
| Einbettungsstörungen |
| Blutungen in den Trophoblasten |
| Chondrodystrophia punctata |
| Verringertes Geburtsgewicht |
| 2. Trimenon (Risiko 15-25%) |
| Mikrocephalie |
| Optikusatrophie |
| Nasenhypoplasie [65] |
| 3. Trimenon (Risiko 5-10%) |
| Blutungen (Purpura cerebri) |
Tab.: 11 Antithrombotische Prophylaxe bei Mitralvitien und bei nichtrheumatischem Vorhofflimmern [61]
| INR | Dauer | |
| Mitralvitien mit Vorhofflimmern | 2,0-3,0 | unbegrenzt |
| Mitralklappenersatz (mech. Prothesen) | 3,0-4,5 | unbegrenzt |
| Mitralklappenersatz (Hochrisikopatient) | 2,0-3,0 | unbegrenzt |
| Nichtrheumatisches Vorhofflimmern Hochrisikopatient
- frühere thromboembolische Ereignisse - Hochdruck |
2,0-3,0 | unbegrenzt |
Zusammenfassung der Arbeit
1. Teil
Das Cumarinderivat Phenprocoumon ist das in Deutschland am häufigsten verwendete Antikoagulans. Antikoagulanzien lassen sich aufgrund ihrer gerinnungshemmenden Wirkung zur Langzeitprophylaxe gegen die Entwicklung oder Ausdehnung von Thromben einsetzen. Weil die Antikoagulanzien die Hämostase beeinflussen, sind ihre Hauptnebenwirkungen die Blutungen. Jedoch erlauben die heutzutage sehr guten Kenntnisse über die Substanzen eine Therapie mit minimierten Nebenwirkungen.
2. Teil
Eine sichere und wirksame Antikoagulanzientherapie erfordert die Mitarbeit des Patienten, die Patientenaufklärung und Beratung. Das Vertrauensverhältnis zwischen Arzt/Apotheker und patient spielt für das Ausmaß der Compliance eine große Rolle. Nur in einem ausführlichen Gespräch können Sinn der Therapie, Wirkungen und Nebenwirkungen verständlich und erinnerbar erklärt werden. Schriftliche Informationen sollten das Beratungsgespräch ergänzen. Im Klinikum der Universität Mainz haben wir versucht, durch einen Konsiliardienst für die mit oralen Antikoagulanzien therapierten Patienten einen Beitrag zur qualitativ optimalen Arzneimittelversorgung der patienten zu leisten. Das überaus positive Echo bei Ärzteschaft und Pflegepersonal und vor allem bei den bisher konsiliraisch betreuten Patienten bestätigt uns, einen weiteren wichtigen Weg betreten zu haben.
Schlüsselwörter: Phenprocoumon-Konsiliardienst-Antikoagulanzien-INR- Pharmakologie-Patient-Beratung
© bei Dr. Alfred Goldinger, Mainz, 1998-bis dato